题目内容
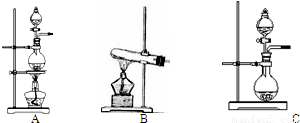
I、下表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2→O2 | |
| ② | 制氨气 | NH4Cl→NH3 | |
| ③ | 制氯气 | HCl→Cl2 |
【答案】分析:(1)根据各自的化学反应原理,反应①③为氧化还原反应,有电子的转移,反应②为非氧化还原反应,无电子的转移,实验室用氯化铵和熟石灰制备;
(3)实验室用H2O2制备氧气,为固体和液体在不加热条件下反应;O元素的电负性大于N元素的电负性,以此分析;
(4)①根据溶液稀释前后溶质的物质的量不变进行计算;
②容量瓶不能用待配溶液润洗;不能在容量瓶中稀释溶液;
II、(1)根据离子方程式书写规则书写离子方程式;
(2)酸、碱都是强电解质,等体积混合后溶液呈中性,说明氢离子和氢氧根离子的物质的量相等,结合水的离子积常数确定pH.
解答:解:(1)反应①过氧化氢在二氧化锰的催化作用下生成水和氧气,2H2O2 2H2O+O2↑;反应②实验室用氯化铵和熟石灰制备,反应的方程式为:Ca(OH)2+2NH4Cl
2H2O+O2↑;反应②实验室用氯化铵和熟石灰制备,反应的方程式为:Ca(OH)2+2NH4Cl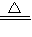 CaCl2+2NH3↑+2H2O;反应③二氧化锰与足量的浓盐酸反应:MnO2+4HCl(浓)
CaCl2+2NH3↑+2H2O;反应③二氧化锰与足量的浓盐酸反应:MnO2+4HCl(浓)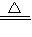 MnCl2+Cl2↑+2H2O反应中,氯化氢为还原剂,二氧化锰为氧化剂,反应①③为氧化还原反应,有电子的转移,反应②为非氧化还原反应,无电子的转移,实验室用氯化铵和熟石灰制备,反应的方程式为:Ca(OH)2+2NH4Cl
MnCl2+Cl2↑+2H2O反应中,氯化氢为还原剂,二氧化锰为氧化剂,反应①③为氧化还原反应,有电子的转移,反应②为非氧化还原反应,无电子的转移,实验室用氯化铵和熟石灰制备,反应的方程式为:Ca(OH)2+2NH4Cl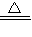 CaCl2+2NH3↑+2H2O,
CaCl2+2NH3↑+2H2O,
故答案为:Cl2;NH3; Ca(OH)2+2NH4Cl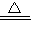 CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(3)实验室用H2O2制备氧气,2H2O2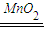 2H2O+O2↑,为固体和液体在不加热条件下反应,如用制备氧气的装置制备氨气,可用浓氨水和氢氧化钠(或生石灰或碱石灰),用氢氧化钠或生石灰或碱石灰吸水放热的特点制备氨气;O元素的电负性大于N元素的电负性,则水中的H原子为裸露的质子,依此可得形成的NH3?H2O的合理结构
2H2O+O2↑,为固体和液体在不加热条件下反应,如用制备氧气的装置制备氨气,可用浓氨水和氢氧化钠(或生石灰或碱石灰),用氢氧化钠或生石灰或碱石灰吸水放热的特点制备氨气;O元素的电负性大于N元素的电负性,则水中的H原子为裸露的质子,依此可得形成的NH3?H2O的合理结构
故答案为:浓氨水和氢氧化钠(或生石灰或碱石灰);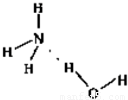 ;
;
(4)①溶液稀释前后溶质的物质的量不变,则有8mol/L×0.1L=V×12mol/L,V=0.0667L=66.7mL,
故答案为:66.7;
②容量瓶不能用待配溶液润洗;不能在容量瓶中稀释溶液,容量瓶在使用前要检查是否漏水,定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次,使溶液充分混合,则不正确的是BC,
故答案为:BC.
II、(1)c(OH-)/c(H+)=1×10-8,c(OH-)×c(H+)=1×10-14,所以c(OH-)=10-11mol?L-1,则c(H+)=10-3mol?L-1,所以溶液的pH=3;氢离子浓度小于酸的浓度,所以该酸是弱酸,该酸(HA)与NaOH溶液反应的离子方程式为:HA+OH-═A-+H2O,故答案为:HA+OH-═A-+H2O;
(2)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,水的离子积为10-13,即酸、碱浓度相等时pH(酸)+pH(碱)=13,将100mL 0.1mol?L-1的稀H2SO4溶液与100mL 0.4mol?L-1的NaOH溶液混合后,溶液中c(OH-)= =1×10-1mol?L-1,Kw=c(OH-)×c(H+)=1×10-13,则c(H+)=10-12mol?L-1,pH=-lg(1×10-12)=12,
=1×10-1mol?L-1,Kw=c(OH-)×c(H+)=1×10-13,则c(H+)=10-12mol?L-1,pH=-lg(1×10-12)=12,
故答案为:12.
点评:本题考查了物质的制备、溶液的配制等基本实验操作,溶液的PH的计算等知识点,注意利用信息和所学知识结合即可解答,题目难度中等.
(3)实验室用H2O2制备氧气,为固体和液体在不加热条件下反应;O元素的电负性大于N元素的电负性,以此分析;
(4)①根据溶液稀释前后溶质的物质的量不变进行计算;
②容量瓶不能用待配溶液润洗;不能在容量瓶中稀释溶液;
II、(1)根据离子方程式书写规则书写离子方程式;
(2)酸、碱都是强电解质,等体积混合后溶液呈中性,说明氢离子和氢氧根离子的物质的量相等,结合水的离子积常数确定pH.
解答:解:(1)反应①过氧化氢在二氧化锰的催化作用下生成水和氧气,2H2O2
 2H2O+O2↑;反应②实验室用氯化铵和熟石灰制备,反应的方程式为:Ca(OH)2+2NH4Cl
2H2O+O2↑;反应②实验室用氯化铵和熟石灰制备,反应的方程式为:Ca(OH)2+2NH4Cl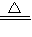 CaCl2+2NH3↑+2H2O;反应③二氧化锰与足量的浓盐酸反应:MnO2+4HCl(浓)
CaCl2+2NH3↑+2H2O;反应③二氧化锰与足量的浓盐酸反应:MnO2+4HCl(浓)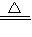 MnCl2+Cl2↑+2H2O反应中,氯化氢为还原剂,二氧化锰为氧化剂,反应①③为氧化还原反应,有电子的转移,反应②为非氧化还原反应,无电子的转移,实验室用氯化铵和熟石灰制备,反应的方程式为:Ca(OH)2+2NH4Cl
MnCl2+Cl2↑+2H2O反应中,氯化氢为还原剂,二氧化锰为氧化剂,反应①③为氧化还原反应,有电子的转移,反应②为非氧化还原反应,无电子的转移,实验室用氯化铵和熟石灰制备,反应的方程式为:Ca(OH)2+2NH4Cl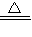 CaCl2+2NH3↑+2H2O,
CaCl2+2NH3↑+2H2O,故答案为:Cl2;NH3; Ca(OH)2+2NH4Cl
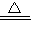 CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;(3)实验室用H2O2制备氧气,2H2O2
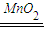 2H2O+O2↑,为固体和液体在不加热条件下反应,如用制备氧气的装置制备氨气,可用浓氨水和氢氧化钠(或生石灰或碱石灰),用氢氧化钠或生石灰或碱石灰吸水放热的特点制备氨气;O元素的电负性大于N元素的电负性,则水中的H原子为裸露的质子,依此可得形成的NH3?H2O的合理结构
2H2O+O2↑,为固体和液体在不加热条件下反应,如用制备氧气的装置制备氨气,可用浓氨水和氢氧化钠(或生石灰或碱石灰),用氢氧化钠或生石灰或碱石灰吸水放热的特点制备氨气;O元素的电负性大于N元素的电负性,则水中的H原子为裸露的质子,依此可得形成的NH3?H2O的合理结构故答案为:浓氨水和氢氧化钠(或生石灰或碱石灰);
 ;
;(4)①溶液稀释前后溶质的物质的量不变,则有8mol/L×0.1L=V×12mol/L,V=0.0667L=66.7mL,
故答案为:66.7;
②容量瓶不能用待配溶液润洗;不能在容量瓶中稀释溶液,容量瓶在使用前要检查是否漏水,定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次,使溶液充分混合,则不正确的是BC,
故答案为:BC.
II、(1)c(OH-)/c(H+)=1×10-8,c(OH-)×c(H+)=1×10-14,所以c(OH-)=10-11mol?L-1,则c(H+)=10-3mol?L-1,所以溶液的pH=3;氢离子浓度小于酸的浓度,所以该酸是弱酸,该酸(HA)与NaOH溶液反应的离子方程式为:HA+OH-═A-+H2O,故答案为:HA+OH-═A-+H2O;
(2)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,水的离子积为10-13,即酸、碱浓度相等时pH(酸)+pH(碱)=13,将100mL 0.1mol?L-1的稀H2SO4溶液与100mL 0.4mol?L-1的NaOH溶液混合后,溶液中c(OH-)=
 =1×10-1mol?L-1,Kw=c(OH-)×c(H+)=1×10-13,则c(H+)=10-12mol?L-1,pH=-lg(1×10-12)=12,
=1×10-1mol?L-1,Kw=c(OH-)×c(H+)=1×10-13,则c(H+)=10-12mol?L-1,pH=-lg(1×10-12)=12,故答案为:12.
点评:本题考查了物质的制备、溶液的配制等基本实验操作,溶液的PH的计算等知识点,注意利用信息和所学知识结合即可解答,题目难度中等.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
 I、下表是实验室制备气体的有关内容:
I、下表是实验室制备气体的有关内容:
| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2→O2 | |
| ② | 制氨气 | NH4Cl→NH3 | |
| ③ | 制氯气 | HCl→Cl2 |
(2)根据表中所列实验原理,从下列装置中选择合适的发生装置,将其编号填入上表的空格中.
(3)若用上述制备O2的装置制备NH3,则选择的试剂为______.
已知:NH3?H2O的电离方程式为:NH3?H2O?NH+4+OH-,试写出NH3溶于水后,形成的NH3?H2O的合理结构______
(4)制备Cl2需用8mol?L-1的盐酸100mL,现用12mol?L-1的盐酸来配制.
①需要12mol?L-1的盐酸的体积为______mL(精确到0.1mL)
②在容量瓶的使用方法中,下列操作不正确的是______(填写标号).
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时用量筒量取浓盐酸后用玻璃棒引流入容量瓶中,缓慢加入蒸馏水到接近标线1cm~2cm处,用胶头滴管滴加蒸馏水直到凹液面的最低处和标线相平
D.定容后盖好瓶塞,用食指顶住,用另一只手手指托住瓶底,把容量瓶倒转和摇动多次
II、(1)常温下,已知0.1mol?L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8.
写出该酸HA与NaOH溶液反应的离子方程式式:______;
(2)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,
则该温度下(t℃),将100mL 0.1mol?L-1的稀H2SO4溶液与100mL 0.4mol?L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=______.
下表是短周期表中的一部分,根据A—J在周期表中的位置,完成下列问题:
| A | |||||||
| D | F | G | J | ||||
| B | C | E | H | I |
(1) 元素A和F形成的极易溶于水的气态化合物电子式为 ,写出实验室制备该化合物的化学方程式 ,
工业制备该化合物的化学方程式为 。
(2)写出D在周期表中位置:第 周期第 族。
⑶B、C两种元素中,写出阳离子半径较小的阳离子结构示意图__________。
(4)在上述元素中,可以找到作光导纤维的材料的两种元素,该化合物是 ,
属于 晶体。
⑸元素E与元素F组成的化合物X可用作耐高温、耐磨的材料;E与I组成的化合物W可用作烟幕弹,原理是化合物W遇水就剧烈反应,非氧化还原反应,常温下,W为无色透明液体;F与I组成的化合物Y可用作杀菌消毒、漂白,原理是化合物Y遇水生成氨和次氯酸,非氧化还原反应,常温下,Y为黄色油状液体。
a. 写出W的化学式 。
b. 常温下,X的熔点远远高于W、Y的熔点,理由是 。
c.写出Y与水反应的方程式: 。
d. 比较E的氢化物与F的氢化物热稳定性: > (填化学式)。

 I、下表是实验室制备气体的有关内容:
I、下表是实验室制备气体的有关内容: