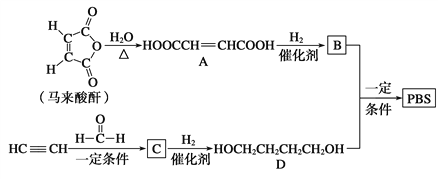
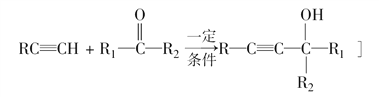
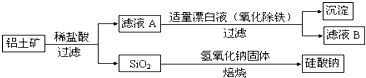
题目内容
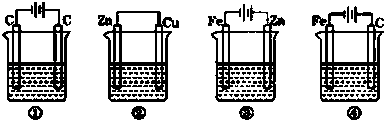
【题目】Zn﹣Cu原电池,H2SO4做电解质溶液.
(1)画出装置图(要求标出正负极及电子流向)
(2)正负极材料
(3)正负极电极方程式.
【答案】
(1)解:利用反应Zn+H2SO4=ZnSO4+H2↑设计原电池时,根据反应可知,Zn为负极,则正极可以是活泼性不如Zn的金属如Cu等,也可以是碳棒,电解质溶液是稀硫酸,
答案为: 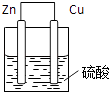
(2)解:根据(1)的分析,Zn为负极,则正极可以是活泼性不如Zn的金属如Cu等,
答案为:Zn为负极,Cu为正极
(3)解:据此设计原电池时,锌为负极,铜为正极,工作时,正极反应式为2H++2e﹣=H2↑,负极反应式为Zn﹣2e﹣=Zn2+,
答案为:2H++2e﹣=H2↑;Zn﹣2e﹣=Zn2+
【解析】利用置换反应Zn+H2SO4=ZnSO4+H2↑,据此设计原电池时,锌为负极,铜为正极,工作时,正极反应式为2H++2e﹣=H2↑,负极反应式为Zn﹣2e﹣=Zn2+ , Zn逐渐溶解,据此分析解答.

练习册系列答案
相关题目