题目内容
12.下列各组离子,在pH=1的溶液中可以大量共存的是( )| A. | Na+、K+、MnO4-、Cl- | B. | Na+、Cl-、NO3-、Ba2+ | ||
| C. | Mg2+、Fe3+、SCN-、Cl- | D. | Fe2+、Na+、NO3-、Cl- |
分析 pH=1的溶液,溶液中含大量的氢离子,根据离子之间不能结合生成沉淀、气体、水、络离子等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.H+、MnO4-、Cl-发生氧化还原反应,不能大量共存,故A不选;
B.该组离子之间不反应,可大量共存,故B选;
C.Fe3+、SCN-结合生成络离子,不能大量共存,故C不选;
D.Fe2+、H+、NO3-发生氧化还原反应,不能大量共存,故D不选;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.C60Si60是一种具有C60和Si60结构的新分子,即把“足球型”的C60置于“足球型”Si60内,Si原子与C原子以共价键结合,合成“二重构造”球形分子C60Si60的化学反应类似于( )
| A. | 乙烯制聚乙烯 | B. | 乙酸与乙醇制乙酸乙酯 | ||
| C. | 乙醇制乙醛 | D. | 苯酚与甲醛制酚醛树脂 |
20.根据表中给出的几种物质的熔沸点数据,判断下列说法错误的是( )
| NaCl | MgCl2 | AlCl3 | SiCl4 | 单质硼 | |
| 熔点/℃ | 810 | 710 | 180 | -68 | 2300 |
| 沸点/℃ | 1 465 | 1 418 | 160 | 57 | 2 500 |
| A. | SiCl4是分子晶体 | B. | 单质硼可能是原子晶体 | ||
| C. | AlCl3加热能升华 | D. | NaCl的键的强度比MgCl2的小 |
7.下列情况会对人体造成较大伤害的是( )
| A. | 用SO2漂白银耳 | |
| B. | 自来水中通入少量氯气消毒杀菌 | |
| C. | 用食醋清洗热水瓶胆内壁附着的水垢(水垢的主要成分为CaCO3、Mg(OH)2) | |
| D. | 用小苏打(NaHCO3)发酵面粉制作馒头 |
17.下列事实中,不能作为元素金属性和非金属性强弱判断依据的是( )
| A. | 钠和镁分别与冷水反应,判断钠和镁的金属性强弱 | |
| B. | 铁投入CuSO4溶液中置换出铜,判断铜与铁的金属性强弱 | |
| C. | 酸性H2CO3<HCl,判断氯与碳的非金属性强 | |
| D. | F2与Cl2分别与足量的H2反应的难易,判断氟与氯的非金属性强弱 |
4.下列有关叙述中正确的是( )
| A. | 因为s轨道的形状是球形的,所以s电子做的是圆周运动 | |
| B. | 3px、3py、3pz的差异之处在于三者中电子(基态)的能量不同 | |
| C. | 原子轨道和电子云都是用来形象地描述电子运动状态的 | |
| D. | 电子云图上的每一个点都代表一个电子 |
2.硼有两种天然同位素105B和115B,硼元素的近似相对原子质量为10.80,则对115B的原子百分比是( )
| A. | 80% | B. | 20% | C. | 40% | D. | 无法计算 |
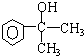 ;F
;F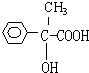 .
. ;
; .
. 、
、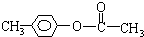 、
、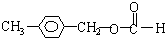 、
、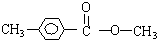 .
.