题目内容
(2010?龙岩模拟)生产、生活离不开各种化学物质,下列说法不正确的是( )
分析:A、根据氯化钠溶解度随温度变化不大,利用蒸发溶剂方法得到氯化钠,淡水是蒸馏方法得到;
B、过氧化钠可以与二氧化碳生成氧气;
C、氯气和碱反应得到次氯酸盐,进一步反应生成次氯酸据有杀菌消毒作用;
D、光导纤维是石英的晶体,成分是二氧化硅;
B、过氧化钠可以与二氧化碳生成氧气;
C、氯气和碱反应得到次氯酸盐,进一步反应生成次氯酸据有杀菌消毒作用;
D、光导纤维是石英的晶体,成分是二氧化硅;
解答:解:A、海水中获得食盐和淡水的方法是通过蒸发溶剂、蒸馏等物理过程实现,故A正确;
B、过氧化钠与二氧化碳反应会生成氧气,提供呼吸需要的氧气,故B正确;
C、氯气和烧碱反应得到次氯酸钠溶液,水解生成次氯酸具有消毒作用,氯气和石灰乳反应生成的次氯酸钙是漂白粉的有效成分,会生成次氯酸具有杀菌消毒作用,故C正确;
D、光导纤维是用二氧化硅制成的,故D错误;
故选D.
B、过氧化钠与二氧化碳反应会生成氧气,提供呼吸需要的氧气,故B正确;
C、氯气和烧碱反应得到次氯酸钠溶液,水解生成次氯酸具有消毒作用,氯气和石灰乳反应生成的次氯酸钙是漂白粉的有效成分,会生成次氯酸具有杀菌消毒作用,故C正确;
D、光导纤维是用二氧化硅制成的,故D错误;
故选D.
点评:本题考查了海水晒盐、得到淡水的原理,氯气、过氧化钠、二氧化硅的性质应用.

练习册系列答案
相关题目
 (2010?龙岩模拟)X、Y、Z、Q为短周期非金属元素,R是长周期元素.X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子.
(2010?龙岩模拟)X、Y、Z、Q为短周期非金属元素,R是长周期元素.X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+离子只有三个电子层且完全充满电子.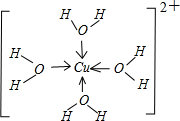
 A.该晶体属于分子晶体
A.该晶体属于分子晶体