题目内容
20.在200℃时,将5mol H2(g)和2mol N2(g)充入到体积为2L的密闭容器中,发生反应:N2(g)+3H2(g)?2NH3(g)(1)反应刚开始时,c(H2)=2.5 mol/L,此时正反应速率最大(填“最大”或“最小”)
(2)随着反应的进行,反应混合物中各组分浓度发生变化,当反应进行到v正=v逆时(填“>”“<”或“=”),此可逆反应就达到了化学平衡状态,
(3)若反应进行到2min时(此时未到达平衡状态)测得剩余的H2为2mol,则这段时间内用H2表示反应的速率为0.75 mol/(L•min),用N2表示反应的速率为0.25 mol/(L•min)此时,NH3的浓度为1mol/L.
分析 (1)反应刚开始时,反应物氢气与氮气的浓度最大,生成物的浓度为0,据此解答即可;
(2)随着反应的进行,反应物的浓度逐渐减小,生成物的浓度相应增大,当反应进行到v正=v逆时,此可逆反应就达到了化学平衡状态;
(3)根据V=$\frac{△c}{△t}$计算H2的反应的速率,根据速率之比等于系数之比计算N2的反应速率,根据消耗的氢气计算此时NH3的浓度.
解答 解:(1)反应刚开始时,c(H2)=$\frac{5mol}{2L}$=2.5mol/L,浓度最大,所以化学反应速率正反应速率最大,故答案为:2.5;最大;
(2)随着反应的进行,反应物的浓度逐渐减小,生成物的浓度相应增大,当反应进行到v正=v逆时,此可逆反应就达到了化学平衡状态,故答案为:=;
(3)若反应进行到2min时(此时未到达平衡状态)测得剩余的H2为2mol,则H2的反应的速率V=$\frac{△c}{△t}$=$\frac{\frac{5-2}{2}}{2}$=0.75mol/(L•min),又速率之比等于系数之比,所以N2表示反应的速率为0.75×$\frac{1}{3}$=0.25mol/(L•min),
根据N2(g)+3H2(g)?2NH3(g),反应进行到2min时(此时未到达平衡状态)测得剩余的H2为2mol,则反应消耗氢气为5-2=3mol,则生成氨气为2mol,所以此时,NH3的浓度为$\frac{2}{2}$=1mol/L,故答案为:0.75;0.25;1.
点评 本题考查了化学反应速率、化学平衡的计算应用等,掌握基础是关键,题目较简单.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
19.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L CCl4中含有的分子数为NA | |
| B. | 常温下,23g Na完全被氧化失去的电子数为NA | |
| C. | 标准状况下,22.4L CH4中含有的电子数为NA | |
| D. | 0.3mol•L-1AlCl3溶液中含有的氯离子数为0.9NA |
8.有机物C11H16中苯环上有两个侧链的同分异构体的数目为(不考虑立体异构)( )
| A. | 12 | B. | 24 | C. | 20 | D. | 18 |
12.下列叙述正确的是( )
| A. | 在碱金属元素中,所有碱金属的氧化物均属于碱性氧化物 | |
| B. | 由于钠、钾的密度都小于1,所以,碱金属单质的密度都小于1 | |
| C. | 金属锂不能保存于煤油中,金属钾可以保存于煤油中 | |
| D. | 碱金属元素单质的熔点按Li、Na、K、Rb、Cs顺序递增,密度也递增 |
9.下列说法中错误的是( )
| A. | C4H10表示纯净的丁烷 | |
| B. | 在相同条件下,燃烧等物质的量的C2H4和乙醇,消耗O2体积相同 | |
| C. | 相对分子质量相同的两种物质一定是同分异构体 | |
| D. | 烯烃各同系物中碳的质量分数都相等 |
10.下列各组中化合物的性质比较,不正确的是( )
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2 | ||
| C. | 稳定性:SiH4>PH3>H2S | D. | 非金属性:F>O>S |
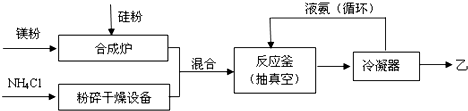
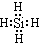 ;比较热稳定性:乙<NH3(填>,<或=).
;比较热稳定性:乙<NH3(填>,<或=).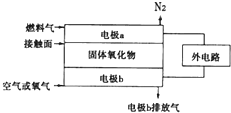 能源与资源是现代社会发展的重要支柱.
能源与资源是现代社会发展的重要支柱.