题目内容
【题目】已知:2CO(g)+O2(g)![]() 2CO2(g) ΔH=566 kJ·mol1;Na2O2(s)+CO2(g)
2CO2(g) ΔH=566 kJ·mol1;Na2O2(s)+CO2(g)![]() Na2CO3(s)+
Na2CO3(s)+![]() O2(g) ΔH=226 kJ·mol1
O2(g) ΔH=226 kJ·mol1
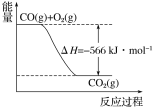
根据以上热化学方程式和图像判断,下列说法正确的是
A.CO的燃烧热为283 kJ
B.上图可表示由1 mol CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>452 kJ·mol1
D.根据以上热化学方程式无法求算Na2O2(s)+CO(g)===Na2CO3(s)的反应热
【答案】C
【解析】燃烧热的单位应为kJ·mol1,A项错误;若表示1 mol CO生成CO2的反应过程和能量关系,则ΔH应为283 kJ·mol1,B项错误;CO2(s)能量比CO2(g)低,因此2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g)放出的热量应小于452 kJ·mol1,因此ΔH>452 kJ·mol1,C项正确;将第一个热化学方程式的反应热除以2加上第二个热化学方程式的反应热可得D项的反应热。

 目标测试系列答案
目标测试系列答案【题目】某同学学习了化学反应速率后,联想到曾用H2O2制备氧气,于是设计了下面的实验方案并进行实验探究.
实验编号 | 反应物 | 催化剂 |
甲 | 试管中加入3mL 2%H2O2溶液和3滴蒸馏水 | 无 |
乙 | 试管中加入3mL 5%H2O2溶液和3滴蒸馏水 | 无 |
丙 | 试管中加入3mL 5%H2O2溶液和3滴蒸馏水 | 1mL 0.1mol/L FeCl3溶液 |
丁 | 试管中加入3mL 5%H2O2溶液和3滴稀盐酸溶液 | 1mL 0.1mol/L FeCl3溶液 |
戊 | 试管中加入3mL 5%H2O2溶液和3滴NaOH溶液 | 1mL 0.1mol/L FeCl3溶液 |
【查阅资料】过氧化氢(H2O2),其水溶液俗称双氧水,常温下是一种无色液体,性质比较稳定.在加热的条件下,它能分解生成氧气.研究表明,将新制的5%的H2O2溶液加热到65℃时就有氧气放出,加热到80℃时就有较多氧气产生.
(1)上述实验发生反应的化学方程式为 .
(2)实验甲和实验乙的实验目的是;实验丙、实验丁和实验戊的实验目的是 .
(3)请根据该同学查阅的资料分析H2O2的性质,解释实验甲和实验乙能否达到实验目的?
(4)实验过程中该同学对实验丙、丁、戊中产生的气体进行收集,并在2分钟内6个时间点对注射器内气体进行读数,记录数据如表.
时间/s | 20 | 40 | 60 | 80 | 100 | 120 | |
气体体积/mL | 实验丙 | 9.5 | 19.5 | 29.0 | 36.5 | 46.0 | 54.5 |
实验丁 | 8.0 | 16.0 | 23.5 | 31.5 | 39.0 | 46.5 | |
实验戊 | 15.5 | 30.0 | 44.5 | 58.5 | 71.5 | 83.0 | |
①对实验戊,0~20s的反应速率v1=mL/s,100~120s的反应速率v2=mL/s.不考虑实验测量误差,二者速率存在差异的主要原因是 .
②如图是根据实验收集到最大体积的气体时所用时间绘制的图象.曲线c表示的是实验(填“丙”、“丁”或“戊”).