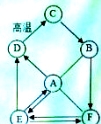
��Ŀ����
����Ŀ��������������X��Y��Z��M��N�����ǵ������ӿ�����SO42����Cl����NO3-��CO32���������ӿ�����Ag+��NH4+��Na+��Al3+��Cu2+��Ba2+��Fe3+����֪��
��M����ɫ��Ӧ�ʻ�ɫ���������ξ�����ˮ��ˮ��Һ��Ϊ��ɫ����X����Һ�����ԣ�Y��Z��N����Һ�����ԣ�M����Һ�ʼ��ԡ��������������ε���Һ�зֱ����Ba(NO3)2��Һ��ֻ��X��Z����Һ�������������������������ε���Һ�У��ֱ���백ˮ��N��Z����Һ�����ɳ����������Ӱ�ˮ��Z�г�����ʧ������X����Һ�ֱ���뵽Y��Z��N����Һ�У��������ɲ�����ϡ����ij�������ش��������⣺
��1���������У�������������ͬ�������εĻ�ѧʽ�� ��
��2��M��Һ�Լ��Ե�ԭ����(�����ӷ���ʽ��ʾ)____________________________
��3��X��Z����Һ��Ӧ�����ӷ���ʽ��____________________
��4��N������ˮ��Ӧ�����ӷ���ʽ��___________________________
��5����Ҫ����Y�������������ӣ���ȷ��ʵ�鷽����_____________________
���𰸡���1��(NH4)2SO4��Al2(SO4)3
��2��CO32-+H2O![]() HCO3��+OH��
HCO3��+OH��
��3��Ag++Cl��===AgCl����
��4��Al3++3NH3��H2O===Al(OH)3��+3NH4+
��5��ȡ����B���Թ��У�����ŨNaOH��Һ�����ȣ���ʪ��ĺ�ɫʯ����ֽ�����Թܿڣ��۲��Ƿ����ɫ
��������
�����������M����ɫ��Ӧ�ʻ�ɫ��˵��M�����Ρ��������ξ�����ˮ��ˮ��Һ��Ϊ��ɫ��˵������ͭ�Ρ����Ρ���X����Һ�����ԣ�˵��X��ǿ��ǿ���Σ�Y��Z��N����Һ�����ԣ�˵��Y��Z��N��ǿ�������Σ�M����Һ�ʼ��ԣ�˵��M��ǿ�����������������M��̼�������������������ε���Һ�зֱ����Ba(NO3)2��Һ��ֻ��X��Z����Һ������������˵��X��Z�������λ�̼���Ρ��������������ε���Һ�У��ֱ���백ˮ��N��Z����Һ�����ɳ����������Ӱ�ˮ��Z�г�����ʧ��˵��Z����������N������������X����Һ�ֱ���뵽Y��Z��N����Һ�У��������ɲ�����ϡ����ij�����˵��x�����Σ��������X���Ȼ�����Y�������Σ��������Y������泥������N������������1���������У�������������ͬ�������εĻ�ѧʽ��(NH4)2SO4��Al2(SO4)3
��2��̼������Һ�Լ��Ե�ԭ����̼�������ˮ��(�����ӷ���ʽ��ʾ) CO32-+H2O![]() HCO3��+OH��
HCO3��+OH��
��3��X��Z����Һ��Ӧ�����ӷ���ʽ��Ag++Cl��===AgCl��
��4��N������ˮ��Ӧ�����ӷ���ʽ��Al3++3NH3��H2O===Al(OH)3��+3NH4+
��5����Ҫ����Y�������������ӣ���ȷ��ʵ�鷽����ȡ����B���Թ��У�����ŨNaOH��Һ�����ȣ���ʪ��ĺ�ɫʯ����ֽ�����Թܿڣ��۲��Ƿ����ɫ��