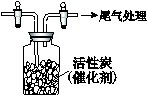题目内容
三硫化四磷用于制造火柴及火柴盒摩擦面,分子结构如下图所示。下列有关三硫化四磷说法中正确的是
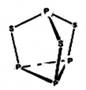

| A.该物质中磷元素的化合价为+3 |
B.该物质分子中含有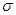 键和 键和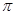 键 键 |
| C.该物质的熔、沸点比食盐高 |
| D.该物质22g含硫原子的数目约为1.806×1023 |
D
试题分析:A.在P4S3分子中,最上边的P化合价为+3价,下边是3个P的化合价为+1价。错误。B.在物质分子中只有
 键。错误。C.该物质是物质晶体,熔沸点比离子化合物食盐低。错误。D.22g该物质的物质的量为22g÷220g/mol=0.1mol,每1mol的该化合物中含有S原子3mol,所以含硫原子的数目约为0.1mol×3×NA=1.806×1023.正确。
键。错误。C.该物质是物质晶体,熔沸点比离子化合物食盐低。错误。D.22g该物质的物质的量为22g÷220g/mol=0.1mol,每1mol的该化合物中含有S原子3mol,所以含硫原子的数目约为0.1mol×3×NA=1.806×1023.正确。
练习册系列答案
相关题目
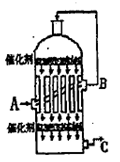
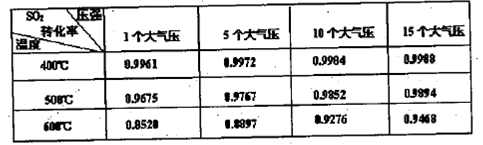
 L/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式
L/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式