题目内容
13.A.《化学与生活》(1)改善空气质量,保护水资源,营造健康舒适的生存环境,已成为全人类的共识.
①向煤中加入石灰石作为脱硫剂,可以减少SO2的排放,生成CaSO4.发生反应的化学方程式为2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2.
②自来水生产过程中通常要经过加入混凝剂、活性炭和臭氧等物质的处理,其中臭氧主要作用是消毒剂.
③硝酸型酸雨的形成主要是由汽车排放的尾气所致.采用给汽车安装尾气净化装置,使其中的有害气体NO,CO在催化剂作用下转化为无害气体是目前最有效的方法,反应的化学方程式为2NO+2CO=N2+2CO2.
(2)合理膳食、合理用药是人体健康的需要.
①某肉制品包装上印有相关配料:精选瘦肉、食盐、亚硝酸钠、苯甲酸钠.其中属于调味剂的是食盐,属于发色剂的是亚硝酸钠,属于防腐剂的是苯甲酸钠.
②维生素C是一种重要维生素,能防治坏血病.用淀粉溶液、碘水为试剂,验证维生素C具有还原性的实验操作和现象是取少许淀粉溶液,加入数滴碘水呈蓝色,再加入维生素C,振荡后溶液蓝色褪去.
③某品牌抗酸药的主要成分有糖衣、碳酸镁、淀粉.写出该抗酸药发挥功效时的离子方程式:MgCO3+2H+═Mg2++CO2↑+H2O.
④餐饮业产生的“地沟油”的主要成分是油脂.综合利用“地沟油”的一种方法是将“地沟油”中的油脂水解以获取高级脂肪酸和甘油(填名称).将废弃塑料进行裂解处理,可以获得乙烯、丙烯等化工原料.
(3)生活中所用的物品离不开各种材料.
①用于包装食品的塑料袋,应用聚乙烯塑料 (填“聚乙烯塑料”或“聚氯乙烯塑料”);制作电源插座的塑料是热固性塑料 填“热塑性塑料”或“热固性塑料”).
②炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑.
试回答:铁锅的腐蚀主要是由吸氧腐蚀造成的.为防止轮船的船体在海水中被腐蚀,一般在船身连接锌块(填“锌块”或“铜块”).
③在普通玻璃制造过程中,碳酸钙与二氧化硅在高温下发生反应的化学方程式是
CaCO3+SiO2 $\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑.橡胶是制造轮胎的重要原料,天然橡胶通过硫化措施,使它的分子转化为网状结构,从而增大橡胶的强度.
分析 (1)①煤燃烧生成的二氧化硫能够与碳酸钙、氧气反应生成硫酸钙和二氧化碳;
②臭氧有强氧化性;
③NO、CO在催化剂作用下转化为氮气和二氧化碳;
(2)①精选瘦肉是主料;食盐为调味剂,用于调味;亚硝酸钠是发色剂、防腐剂,使肉制品颜色鲜艳;苯甲酸钠做防腐剂,延长食品存放时间;
②根据碘单质遇淀粉变蓝色,碘单质能被维生素C还原,淀粉溶液褪色;
③碳酸镁和盐酸反应生成氯化镁、水和二氧化碳;
④油脂水解生成甘油和高级脂肪酸;塑料主要成分为聚乙烯,可裂解生成乙烯、丙烯等;
(3)①聚乙烯塑料可用来包装食品;热塑性塑料加热后可重塑,热固性塑料加热后不可重塑;
②依据钢铁的腐蚀和防护原理解答;
③碳酸钙与二氧化硅反应生成硅酸钙和二氧化碳;根据橡胶硫化对分子结构的影响分析.
解答 解:(1)①煤燃烧生成的二氧化硫能够与碳酸钙、氧气反应生成硫酸钙和二氧化碳,化学方程式:2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2,故答案为:2CaCO3+O2+2SO2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2;
②臭氧有强氧化性,能杀菌消毒,故答案为:消毒剂;
③NO、CO在催化剂作用下转化为氮气和二氧化碳,反应的方程式为2NO+2CO=N2+2CO2,故答案为:2NO+2CO=N2+2CO2;
(2)①向食品中加入调味剂,能改善或改变食品的口味.常见的调味剂为食盐;亚硝酸钠是发色剂、防腐剂;苯甲酸钠是常用的防腐剂,
故答案为:食盐;亚硝酸钠;苯甲酸钠;
②碘单质遇淀粉变蓝色,碘单质能被维生素C还原后蓝色褪去,
故答案为:取少许淀粉溶液,加入数滴碘水呈蓝色,再加入维生素C,振荡后溶液蓝色褪去;
③碳酸镁和盐酸反应生成氯化镁、水和二氧化碳,反应的离子方程式为:MgCO3+2H+═Mg2++CO2↑+H2O,故答案为:MgCO3+2H+═Mg2++CO2↑+H2O;
④油脂为高级脂肪酸甘油酯,水解可生成甘油和高级脂肪酸;塑料主要成分为聚乙烯,可裂解生成乙烯、丙烯,故答案为:甘油;裂解;
(3)①聚乙烯塑料可用来包装食品;电源插座应受热不易变形,所以是热固性塑料,故答案为:聚乙烯塑料;热固性塑料;
②铁锅未及时洗净(残液中含NaCl)能发生电化学腐蚀,由于电解质溶液为中性所以发生吸氧腐蚀;锌比铁还原性强,在海水中形成原电池,锌做负极发生氧化反应,被腐蚀;铁做正极被保护属于牺牲阳极的阴极保护法;
故答案为:吸氧;锌块;
③在普通玻璃制造过程中,碳酸钙与二氧化硅在高温下发生反应生成硅酸钙和二氧化碳,其反应方程式为:CaCO3+SiO2 $\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑;天然橡胶通过硫化,使它的分子形成网状结构,从而增大橡胶的强度;
故答案为:CaCO3+SiO2 $\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑;网状.
点评 本题考查了环境污染、食品添加剂、金属的腐蚀、橡胶等,侧重于化学知识在生产生活中应用的考查,题目难度不大.

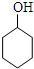 $→_{85℃}^{浓H_{2}SO_{4}}$
$→_{85℃}^{浓H_{2}SO_{4}}$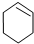 +H2O,
+H2O,| 密度 (g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)在不少实验中都用到水浴加热,水浴加热的特点是受热均匀,易控制加热温度,加热不超过100℃;
(2)A中瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝;
(3)试管C置于冰水浴中的目的是进一步冷却,防止环己烯挥发.
制备精品:
(4)环己烯粗品中含有环己醇和少量酸性杂质等.加入少量食盐水,振荡、静置、分层,环己烯在上层层(填“上”或“下”),分液后用c(填入编号)洗涤;a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液 d.溴水
(5)再将环己烯按图2装置蒸馏,冷却水从g(填字母)口进入,蒸馏时要加入生石灰,目的是除去了残留的水.
(6)收集产品时,温度应控制在83℃左右,实验值得的环己烯精品低于理论产量,可能的原因是c;
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备精品时环己醇随产品一起蒸出
(7)以下区分环己烯精品与粗品的方法,合理的是bc.
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
| A. | G→a→c→f→b→d→c→b | B. | G→c→b→d→c→f→c→a | C. | G→a→e→f→b→d→c | D. | G→b→f→a→d→c→b |
| A. | ①中的离子反应方程式是:Na++NH3+CO2+H2O=NaHCO3↓+NH4+ | |
| B. | ②中的离子反应方程式是:2Na++CO32-+H2O+CO2=2NaHCO3↓ | |
| C. | 上述变化说明相同温度下溶解度Na2CO3>NaHCO3>NaCl | |
| D. | 向饱和CaCl2溶液中加入浓Ba(OH)2溶液,也会析出晶体 |
| A. | 用蒸发皿加热NaCl溶液 | |
| B. | 不慎将汞滴落到桌面上,应立即用较多的水冲洗 | |
| C. | 从试剂瓶中取出的一些Na2CO3溶液放入试管中,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| D. | 用瓷坩埚熔化氢氧化钠 |
 的是( )
的是( )| A. | CH3-CH═CH-CH3 | B. | CH2═CH2 | ||
| C. | CH2═CCH3CH3 | D. | 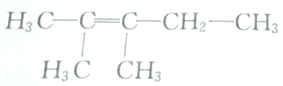 |
| A. | 0.1mol/L | B. | 0.5mol/L | C. | 4mol/L | D. | 1mol/L |

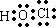 .在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$ ClO-+H2↑;.将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式ClO-+SO32-=Cl-+SO42-.
.在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$ ClO-+H2↑;.将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式ClO-+SO32-=Cl-+SO42-.