题目内容
硒是制光电池的一种原料,人体缺少硒就会得“克山病”,从电解精炼铜的阳极泥中提取硒的流程如图1,请回答下列问题:
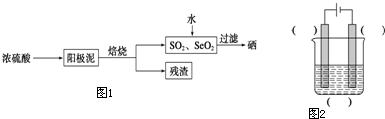
(1)实验室中电解精炼铜的简易装置如图2所示,请在图中标出电极材料和电解液的名称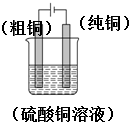
 .
.
(2)阳极泥中硒以Se、Ag2Se、Cu2Se等形式存在,Se和浓硫酸反应的化学方程式为
(3)SeO2溶于水得H2SeO3(Ka1=3.5×10-3,Ka2=5.0×10-8),亚硒酸溶液与SO2反应制硒的离子方程式为
(4)上述硒的提取过程中存在的主要问题是

(1)实验室中电解精炼铜的简易装置如图2所示,请在图中标出电极材料和电解液的名称


(2)阳极泥中硒以Se、Ag2Se、Cu2Se等形式存在,Se和浓硫酸反应的化学方程式为
Se+2H2SO4(浓)
SeO2↑+2SO2↑+2H2O
| ||
Se+2H2SO4(浓)
SeO2↑+2SO2↑+2H2O
.
| ||
(3)SeO2溶于水得H2SeO3(Ka1=3.5×10-3,Ka2=5.0×10-8),亚硒酸溶液与SO2反应制硒的离子方程式为
H2SeO3+2SO2+H2O═Se+2SO42-+4H+
H2SeO3+2SO2+H2O═Se+2SO42-+4H+
.电解亚硒酸溶液可制得强酸H2SeO4,则电解时的阳极反应式为H2SeO3-2e-+H2O═SeO42-+4H+
H2SeO3-2e-+H2O═SeO42-+4H+
.(4)上述硒的提取过程中存在的主要问题是
浓硫酸的腐蚀性强
浓硫酸的腐蚀性强
、焙烧过程中产生大量有毒气体SO2,污染环境
焙烧过程中产生大量有毒气体SO2,污染环境
.分析:(1)电解精炼铜时粗铜作阳极,纯铜作阴极,CuSO4溶液作电解液;
(2)根据流程图可知硒的氧化产物为SeO2,浓硫酸的还原产物为SO2,由此可得出化学方程式;
(3)根据题中提示H2SeO3是弱酸,在离子方程式中应写化学式;电解亚硒酸溶液时,阳极发生氧化反应生成硒酸;
(4)根据浓硫酸、二氧化硫的性质分析解答.
(2)根据流程图可知硒的氧化产物为SeO2,浓硫酸的还原产物为SO2,由此可得出化学方程式;
(3)根据题中提示H2SeO3是弱酸,在离子方程式中应写化学式;电解亚硒酸溶液时,阳极发生氧化反应生成硒酸;
(4)根据浓硫酸、二氧化硫的性质分析解答.
解答:解:(1)电解精炼粗铜时,纯铜作阴极,粗铜作阳极,电解质溶液为可溶性的铜盐,可以选用硫酸铜溶液,其图为 ,
,
故答案为: ;
;
(2)根据流程图可知硒的氧化产物为SeO2,浓硫酸的还原产物为SO2,所以该反应方程式为:Se+2H2SO4(浓)
SeO2↑+2SO2↑+2H2O,
故答案为:Se+2H2SO4(浓)
SeO2↑+2SO2↑+2H2O;
(3)根据题意知,二氧化硫还原亚硒酸生成硒单质,二氧化硫被氧化生成硫酸,离子方程式为:H2SeO3+2SO2+H2O═Se+2SO42-+4H+,根据题意知,阳极上亚硒酸失电子生成硒酸,电极反应式为H2SeO3-2e-+H2O═SeO42-+4H+,
故答案为:H2SeO3+2SO2+H2O═Se+2SO42-+4H+;H2SeO3-2e-+H2O═SeO42-+4H+;
(4)上述硒的提取过程中用到的浓硫酸具有强腐蚀性,对容器要求较高,且在焙烧的过程中产生二氧化硫等有毒气体,会污染环境,所以要有尾气处理装置,
故答案为:浓硫酸的腐蚀性强;焙烧过程中产生大量有毒气体SO2,污染环境.
 ,
,故答案为:
 ;
;(2)根据流程图可知硒的氧化产物为SeO2,浓硫酸的还原产物为SO2,所以该反应方程式为:Se+2H2SO4(浓)
| ||
故答案为:Se+2H2SO4(浓)
| ||
(3)根据题意知,二氧化硫还原亚硒酸生成硒单质,二氧化硫被氧化生成硫酸,离子方程式为:H2SeO3+2SO2+H2O═Se+2SO42-+4H+,根据题意知,阳极上亚硒酸失电子生成硒酸,电极反应式为H2SeO3-2e-+H2O═SeO42-+4H+,
故答案为:H2SeO3+2SO2+H2O═Se+2SO42-+4H+;H2SeO3-2e-+H2O═SeO42-+4H+;
(4)上述硒的提取过程中用到的浓硫酸具有强腐蚀性,对容器要求较高,且在焙烧的过程中产生二氧化硫等有毒气体,会污染环境,所以要有尾气处理装置,
故答案为:浓硫酸的腐蚀性强;焙烧过程中产生大量有毒气体SO2,污染环境.
点评:本题以电解原理为载体考查了物质的制备,明确制备原理是解本题关键,结合物质的性质分析解答,注意运用题给信息,难度中等.

练习册系列答案
相关题目
 如图所示,A、B、C、D、G是五种常见单质,其中A、G为气体.化合物R在常温下呈液态,F为黑色晶体,H为淡黄色粉末,I是玻璃工业的一种原料,图中部分生成物已略去.试回答下列问题:
如图所示,A、B、C、D、G是五种常见单质,其中A、G为气体.化合物R在常温下呈液态,F为黑色晶体,H为淡黄色粉末,I是玻璃工业的一种原料,图中部分生成物已略去.试回答下列问题: