题目内容
下列说法正确的是
| A.pH=2和pH=1的硝酸中c(H+)之比为1:10 |
B.Na2CO3溶液c(Na+)与c(CO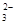 )之比为2:1 )之比为2:1 |
| C.0.2 mol/L与0.1 mol/L醋酸中c(H+)之比为2:1 |
| D.pH=1的硫酸中加入等体积0.05 mol/L的BaCl2溶液,两者恰好反应C(SO42-)=0 |
A
考查溶液的酸碱、pH的概念
A.正确
B.由于CO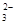 部分水解,所以溶液中c(Na+)与c(CO
部分水解,所以溶液中c(Na+)与c(CO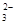 )之比大于2:1
)之比大于2:1
C.稀释弱电解质,促进其电离,故0.2 mol/L与0.1 mol/L醋酸中c(H+)之比小于2:1
D.可看出两溶液恰好反应,得到硫酸钡沉淀(其实是它的饱和溶液),其中的C(SO42-)不可能为零,只不过是非常小而已!
答案为A
A.正确
B.由于CO
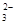 部分水解,所以溶液中c(Na+)与c(CO
部分水解,所以溶液中c(Na+)与c(CO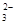 )之比大于2:1
)之比大于2:1C.稀释弱电解质,促进其电离,故0.2 mol/L与0.1 mol/L醋酸中c(H+)之比小于2:1
D.可看出两溶液恰好反应,得到硫酸钡沉淀(其实是它的饱和溶液),其中的C(SO42-)不可能为零,只不过是非常小而已!
答案为A

练习册系列答案
相关题目
 溶液中,下列粒子浓度关系不正确的是
溶液中,下列粒子浓度关系不正确的是