题目内容
下图是用未知浓度的NaOH溶液来滴定10mL盐酸(标准液)所得的曲线(25℃),则下列说法不正确的是( )


| A.标准液盐酸的浓度为0.1 mol/L |
| B.NaOH溶液的浓度为0.05 mol/L |
| C.滴定终点时,俯视碱式滴定管读数,所测NaOH溶液浓度会偏高 |
| D.指示剂变色时,说明盐酸与NaOH恰好完全反应 |
D
试题分析:A.开始时PH为1,可知标准液盐酸的浓度为0.1 mol/L,故A正确;B.加入NaOH溶液20.00mL时,酸碱恰好中和,由c(酸)×V(酸)=c(碱)×V(碱),再由于盐酸的物质的量浓度为0.100 mol?L-1,可知,NaOH溶液的浓度为0.05 mol/L,故B正确;C.滴定终点时,俯视碱式滴定管读数偏小,计算出NaOH溶液浓度会偏高,正确;C.指示剂为酚酞,溶液变色范围为8.2~10,溶液呈碱性,NaOH过量,并不是恰好完全反应,故D错误;故选D.

练习册系列答案
相关题目

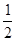 O2(g)=H2O(g);ΔH =+242kJ·mol-1
O2(g)=H2O(g);ΔH =+242kJ·mol-1