题目内容
【题目】已知溴易挥发,碘易升华。向含有NaBr和KI的混合溶液中通入过量氯气,充分反应后将溶液蒸干,并灼烧所得物质,最后剩余的固体是
A. NaCl和KI B. NaCl、KCl C. KCl和NaBr D. KCl和NaCl和I2
【答案】B
【解析】向含有NaBr、KI的混合溶液中通入过量的Cl2充分反应,发生:Cl2+2KI=2KCl+I2,Cl2+2NaBr=2NaCl+Br2,加热时Br2易挥发,I2易升华,最后剩余的固体为KCl和NaCl。故选B。

 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案【题目】合成氨对化学工业和国防工业具有重要意义。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。

①图A中氨气的体积分数为15%时,H2的转化率为_______。
②图B中T=500℃,则温度为450℃时对应的曲线是_______(填“a”或“b”)。
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
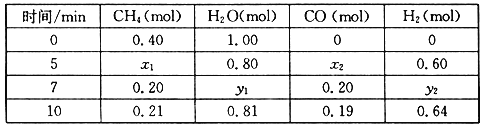
①分析表中数据,判断5 min时反应是否处于平衡状态?_____(填“是”或“否”)。
②该温度下,上述反应的平衡常数K=_____________________。
③反应在7~10 min内,CO的物质的量减少的原因可能是____________(填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④下列方法中可以证明上述反应已达平衡状态的是___________。
a.单位时间内生成3n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CH4的质量分数不再变化
⑤已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
气化反应式 | lgK | ||
700K | 900K | 1200K | |
C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
则反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_______。
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_______。
(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g)![]() pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
压强p/Pa | 2×105 | 5×105 | 1×106 |
c(A)/molL-1 | 0.08 | 0.20 | 0.44 |
①当压强从2×105Pa增加到5×105Pa时,平衡______移动(填“正向、逆向或不”)。
②当压强为1×106Pa时,此反应的平衡常数表达式为______________。
【题目】下列实验操作、现象及得出的结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向盛有品红的两只试管中分别通入SO2和Cl2 | 品红均褪色 | 两者漂白原理相同 |
B | 向体积相同且pH均为3.3的一元酸HX和HY中分别加入足量锌粒 | 产生的H2前者比后者多 | HX、HY均是弱酸 |
C | 在难溶性FeS和CuS中分别加入0.3mol/L盐酸 | 前者溶解,后者不溶 | Ksp(FeS)>Ksp(CuS) |
D | 向盛有相同体积、10%H2O2溶液的两只试管中分别加入足量酸性KMnO4溶液和FeCl3溶液 | 前者产生的气体多 | KMnO4催化活性比FeCl3高 |
A. A B. B C. C D. D






