题目内容
利用氨氧化法制硝酸,继而制取硝酸铵。若氨氧化法制硝酸的利用率为90%,氨转化为硝酸铵的转化率为94%。则100 t氨最多可生产多少吨硝酸铵?
100 t氨最多可生成216.4 t硝酸铵。
氨氧化法制硝酸的反应为:
4NH3+5O2 4NO+6H2O
4NO+6H2O
2NO+O2=2NO2
4NO2+2H2O+O2=4HNO3
所以氨氧化制硝酸的关系式为:
NH3~NO~NO2~HNO3(NH3全部转化为HNO3)
设生产硝酸的质量为x,用于生成HNO3的NH3质量为y生成NH4NO3的质量为z
NH3~NO~NO2~HNO3
17 63
y×90% x
y=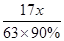
NH3+HNO3=NH4NO3
17 63 80
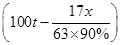 ×94% x z
×94% x z
则17∶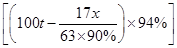 =63∶x
=63∶x
x≈170.4 t
又63∶x=80∶z
z=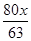 =
=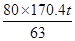 ≈216.4 t
≈216.4 t
4NH3+5O2
 4NO+6H2O
4NO+6H2O2NO+O2=2NO2
4NO2+2H2O+O2=4HNO3
所以氨氧化制硝酸的关系式为:
NH3~NO~NO2~HNO3(NH3全部转化为HNO3)
设生产硝酸的质量为x,用于生成HNO3的NH3质量为y生成NH4NO3的质量为z
NH3~NO~NO2~HNO3
17 63
y×90% x
y=
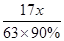
NH3+HNO3=NH4NO3
17 63 80
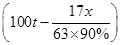 ×94% x z
×94% x z则17∶
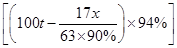 =63∶x
=63∶xx≈170.4 t
又63∶x=80∶z
z=
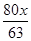 =
=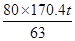 ≈216.4 t
≈216.4 t
练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
