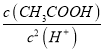题目内容
【题目】下列装置或操作能达到目的的是


A. 装置①用于测定生成氢气的速率
B. 装置②依据褪色快慢比较浓度对反应速率的影响
C. 装置③依据U管两边液面的高低判断Na和水反应的热效应
D. 装置④依据出现浑浊的快慢比较温度对反应速率的影响
【答案】C
【解析】
装置①生成的氢气可以由长颈漏斗溢出;装置②两种高锰酸钾溶液的浓度不同、颜色不同,不符合控制变量法;Na和水反应放热,广口瓶内气体受热膨胀,U型管左侧液面下降,右侧液面上升;装置④中浓度、温度都不同,无法判断温度对速率的影响;
装置①生成的氢气可以由长颈漏斗逸出,不能根据生成氢气的体积测定生成氢气的速率,故A错误;装置②依据褪色快慢比较浓度对反应速率的影响,应保证高锰酸钾溶液的浓度相同,用不同浓度的草酸(乙二酸)来做实验,故B错误;Na和水反应放热,广口瓶内气体受热膨胀,U型管左侧液面下降,右侧液面上升,所以装置③能实现目的,故C正确;装置④中浓度、温度都不同,无法判断温度对速率的影响,故D错误。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】下列实验操作规范且能达到目的的是
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶 |
B. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
C. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A. A B. B C. C D. D