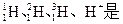题目内容
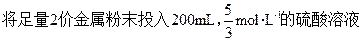 液中,反应完毕后滤去未反应的金属,并在恒温下蒸发,当蒸发到140g溶液时开始析出每分子含7个结晶水的晶体,继续蒸发到析出20.5g晶体时剩下溶液105g。求:①此金属的原子量;②所生成的硫酸盐在蒸发到开始结晶时的溶解度。
液中,反应完毕后滤去未反应的金属,并在恒温下蒸发,当蒸发到140g溶液时开始析出每分子含7个结晶水的晶体,继续蒸发到析出20.5g晶体时剩下溶液105g。求:①此金属的原子量;②所生成的硫酸盐在蒸发到开始结晶时的溶解度。40g
设金属为M,生成MSO4为xmol。
M+H2SO4====MSO4+H2↑
1mol 1mol

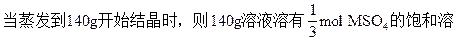
液。140-105=35(g)是减少的饱和溶液的质量,其中有MSO4·7H2O 20.5g,则140g饱和溶液中有MSO4·7H2O为yg。
35∶20.5=140∶y y=82(g)
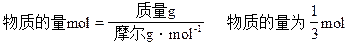
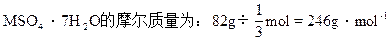
M+96+7×18="246 " M=24
设溶解度为Sg。
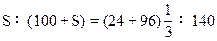
S=40(g)
M+H2SO4====MSO4+H2↑
1mol 1mol

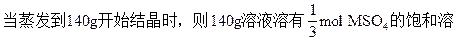
液。140-105=35(g)是减少的饱和溶液的质量,其中有MSO4·7H2O 20.5g,则140g饱和溶液中有MSO4·7H2O为yg。
35∶20.5=140∶y y=82(g)
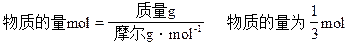
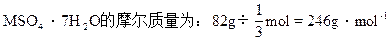
M+96+7×18="246 " M=24
设溶解度为Sg。
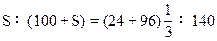
S=40(g)

练习册系列答案
相关题目