题目内容
在下列反应中,水作还原剂的是( )
分析:水作还原剂,则水中的O元素化合价升高,以此判断.
解答:解:A、2F2+2H2O=4HF+O2反应中O元素化合价升高,被氧化,水作还原剂,故A正确;
B、2Na+2H2O=2NaOH+H2O元素化合价不变,H元素化合价降低,被还原,水作氧化剂,故B错误;
C、Cl2+H2O=HCl+HClO反应中O、H元素化合价都不变,水既不是氧化剂,也不是还原剂,故C错误;
D、SO2+H2O=H2SO3反应中O、H元素化合价都不变,水既不是氧化剂,也不是还原剂,故D错误.
故选A.
B、2Na+2H2O=2NaOH+H2O元素化合价不变,H元素化合价降低,被还原,水作氧化剂,故B错误;
C、Cl2+H2O=HCl+HClO反应中O、H元素化合价都不变,水既不是氧化剂,也不是还原剂,故C错误;
D、SO2+H2O=H2SO3反应中O、H元素化合价都不变,水既不是氧化剂,也不是还原剂,故D错误.
故选A.
点评:本题考查氧化还原反应,题目难度不大,注意从化合价的角度判断反应中水的作用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
(16分)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物,实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下: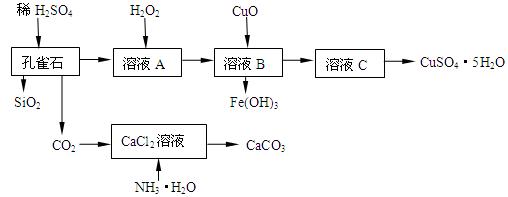
试回答下列问题:
(1)在未加入H2O2的溶液A中,存在的金属离子有Cu2+、Fe2+、Fe3+。若检验该溶液中Fe3+,选择最合适的试剂是 (填代号)。
| A.KMnO4溶液 | B.Fe粉 | C.Na2CO3溶液 | D.KSCN溶液 |
(2)由溶液C获得CuSO4·5H2O,需要经过加热浓缩, ,过滤等操作。除烧杯、漏斗外,过滤操作还需用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
(3)制备CaCO3时,发生反应的化学方程式是 ;若实验过程中有氨气逸出,可选用下列装置中的 (填代号)装置吸收氨气。
(烧杯中的液体都为水)
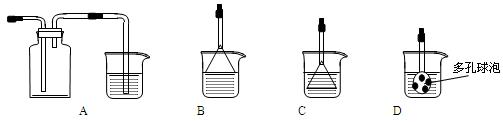
(4)欲测定溶液A中Fe2+的浓度,需配制100 mL 0.1 mol∕LKMnO4标准溶液。配制该溶液时:除烧杯、玻璃棒、胶头滴管外,还需的一种玻璃仪器是 ;当往该玻璃仪器中加蒸馏水至接近刻度线1-2cm时,应改用 滴加蒸馏水至溶液的凹液面正好与刻度线相平。