题目内容
9.下列有关性质的大小关系符合元素周期律的是( )| A. | 金属性:Na>Mg | B. | 稳定性:NH3>H2O | ||
| C. | 碱性:Al(OH)3>Mg(OH)2 | D. | 酸性:HNO3<H2CO3 |
分析 A.同一周期,原子序数越大,金属性越弱;
B.非金属性越强,对应氢化物的稳定性越强;
C.金属性越强,最高价氧化物对应水合物的碱性越强;
D.非金属性越强,最高价氧化物对应水合物的酸性越强.
解答 解:A.Na、Mg位于第三周期,原子序数越大,金属性越弱,原子序数Na<Mg,则金属性:Na>Mg,故A正确;
B.非金属性N<O,则简单氢化物的稳定性:NH3<H2O,故B错误;
C.金属性Al<Mg,则最高价氧化物对应水合物的碱性:Al(OH)3<Mg(OH)2,故C错误;
D.非金属性N>C,则最高价含氧酸的酸性:HNO3>H2CO3,故D错误;
故选A.
点评 本题考查元素周期律的应用,题目难度不大,明确元素周期律的内容为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的综合应用能力.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
19.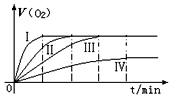 某实验小组以 H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响.按照如下方案完成实验.通过实验得到氧气的体积与时间的关系如图所示,回答下列问题:
某实验小组以 H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响.按照如下方案完成实验.通过实验得到氧气的体积与时间的关系如图所示,回答下列问题:
(1)代表实验①的图示是Ⅳ.
(2)对比实验③和④的目的是探究催化剂对反应速率的影响.
(3)通过上面对比实验,所得的实验结论是其他条件不变,增大反应物浓度或升高温度或加入催化剂,化学反应速率加快.
 某实验小组以 H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响.按照如下方案完成实验.通过实验得到氧气的体积与时间的关系如图所示,回答下列问题:
某实验小组以 H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响.按照如下方案完成实验.通过实验得到氧气的体积与时间的关系如图所示,回答下列问题:| 反应物 | 催化剂 | 温度 | |
| ① | 10mL10% H2O2溶液 | 无 | 25℃ |
| ② | 10mL20% H2O2溶液 | 无 | 25℃ |
| ③ | 10mL20% H2O2溶液 | 无 | 40℃ |
| ④ | 10mL20% H2O2溶液 | 1~2滴0.1mol/L FeCl3溶液 | 40℃ |
(2)对比实验③和④的目的是探究催化剂对反应速率的影响.
(3)通过上面对比实验,所得的实验结论是其他条件不变,增大反应物浓度或升高温度或加入催化剂,化学反应速率加快.
20.只用一种试剂就能将 、
、 、CH3CH2OH鉴别出来,该试剂是( )
、CH3CH2OH鉴别出来,该试剂是( )
 、
、 、CH3CH2OH鉴别出来,该试剂是( )
、CH3CH2OH鉴别出来,该试剂是( )| A. | 溴水 | B. | NaOH溶液 | C. | 饱和Na2CO3溶液 | D. | 银氨溶液 |
17.下列物质中,一定不是天然高分子化合物的是( )
| A. | 橡胶 | B. | 蛋白质 | C. | 油脂 | D. | 纤维素 |
4.下列有关说法正确的是( )
| A. | 共价键一定只存在于共价化合物中 | |
| B. | CH3CH2CH3光照下与氯气反应,只生成1种一氯代烃 | |
| C. | 苯在浓硫酸催化下与浓硝酸的反应是取代反应 | |
| D. | 石油裂解和裂化的目的相同 |
14.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 18gH2O含有10NA个质子 | |
| B. | 标准状况下,22.4LCC14中含有的氯原子数目为4NA | |
| C. | 1molN2与3molH2在一定条件下充分反应生成的NH3分子数为2NA | |
| D. | 78g苯中含有的碳碳双键的数目为3NA |
1.下列实验设计、操作或实验现象合理的是( )
| A. | 实验室制取乙炔时:用饱和食盐水代替蒸馏水,以得到平稳的气流 | |
| B. | 除去苯中的少量苯酚:加入适量溴水溶液,过滤 | |
| C. | 检验甲酸中是否混有乙醛:可向样品中加入足量NaOH溶液以中和甲酸,再做银镜反应或与新制Cu(OH)2共热的实验 | |
| D. | 检验氯乙烷存在的氯元素:向氯乙烷中加入稀NaOH溶液共煮几分钟,再加入AgNO3溶液,观察是否生成白色沉淀 |
18.下列溶液中,溶质的阴离子和阳离子的物质的量浓度相等的是( )
| A. | NaHSO3 | B. | CH3COONa | C. | NaCl | D. | MgSO4 |
19.分别加入适量下列物质,能使湿润的淀粉-KI试纸变蓝的是( )
| A. | NaCl | B. | Fe粉 | C. | 盐酸 | D. | 氯气 |