题目内容
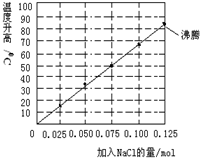 常温下,向加有100mL水的隔热容器中分别加入0.10mol镁粉、0.50mol铁粉及不同物质的量的氯化钠粉末,不断搅拌,实验时分别记录反应过程中0-15min时温度升高的幅度(参见图),下列说法错误的是( )
常温下,向加有100mL水的隔热容器中分别加入0.10mol镁粉、0.50mol铁粉及不同物质的量的氯化钠粉末,不断搅拌,实验时分别记录反应过程中0-15min时温度升高的幅度(参见图),下列说法错误的是( )分析:A、NaCl是电解质,增加浓度不会降低反应速率,0.125molNaCl对应的温度大约为85度;
B、根据温度-NaCl量直线,可算出0.06molNaCl所对应的温度接近于42度;
C、镁放出电子,H+在铁粉处得到电子,组成原电池;
D、镁条的比表面积比镁粉小,即反应的面积小,所以反应速度也要慢于镁粉,当NaCl为0.075mol时,镁条的温度会低于镁粉的温度.
B、根据温度-NaCl量直线,可算出0.06molNaCl所对应的温度接近于42度;
C、镁放出电子,H+在铁粉处得到电子,组成原电池;
D、镁条的比表面积比镁粉小,即反应的面积小,所以反应速度也要慢于镁粉,当NaCl为0.075mol时,镁条的温度会低于镁粉的温度.
解答:解:A、NaCl的用量不必大于0.125mol原因是已经达到沸腾,再加也不会引起温度变化,故A错误;
B、如果在实验中加入了0.060molNaCl,则第15min时混合物的温度接近于62℃,因为图示的是温度升高数值,而不是混合物温度(可以看出升高80多度就已经沸腾,说明没有反应时是17度左右),故B错误;
C、镁、铁和氯化钠溶液之间可以构成原电池,故C正确;
D、镁条比镁粉表面积小,反应升温慢,当加入0.075molNaCl时,镁条的温度会低于镁粉的温度,纵坐标数值会小于50,故D正确;
故选AB.
B、如果在实验中加入了0.060molNaCl,则第15min时混合物的温度接近于62℃,因为图示的是温度升高数值,而不是混合物温度(可以看出升高80多度就已经沸腾,说明没有反应时是17度左右),故B错误;
C、镁、铁和氯化钠溶液之间可以构成原电池,故C正确;
D、镁条比镁粉表面积小,反应升温慢,当加入0.075molNaCl时,镁条的温度会低于镁粉的温度,纵坐标数值会小于50,故D正确;
故选AB.
点评:本题考查了物质性质的实验分析判断,图象分析应用是解题关键,题目难度较大.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案
相关题目
