题目内容
3.相同质量的SO2和SO3它们之间的关系是( )| A. | 氧元素的质量比为5:6 | B. | 氧原子的物质的量之比为3:2 | ||
| C. | 所含硫原子的物质的量之比为1:1 | D. | 硫元素的质量比为4:5 |
分析 SO2和SO3的摩尔质量分别是64g/mol、80g/mol,二者摩尔质量之比=64g/mol:80g/mol=4:5,相同质量的SO2和SO3的物质的量之比=$\frac{1}{64}:$$\frac{1}{80}$=5:4;
A.因为O元素摩尔质量相等,所以两种物质中O元素的质量之比等于二者物质的量与O原子个数之积的比;
B.因为O元素的摩尔质量相等,所以O原子的物质的量之比等于两种物质的物质的量与O原子个数乘积之比;
C.每个分子中都只含一个S原子,所以S原子的物质的量之比等于两种物质的物质的量之比;
D.因为S元素的摩尔质量相等,所以S元素的质量之比等于其物质的量之比.
解答 解:SO2和SO3的摩尔质量分别是64g/mol、80g/mol,二者摩尔质量之比=64g/mol:80g/mol=4:5,相同质量的SO2和SO3的物质的量之比=$\frac{1}{64}:$$\frac{1}{80}$=5:4;
A.因为O元素摩尔质量相等,所以两种物质中O元素的质量之比等于二者物质的量与O原子个数之积的比=(5×2):(4×3)=5:6,故A正确;
B.因为O元素的摩尔质量相等,所以O原子的物质的量之比等于两种物质的物质的量与O原子个数乘积之比=(5×2):(4×3)=5:6,故B错误;
C.每个分子中都只含一个S原子,所以S原子的物质的量之比等于两种物质的物质的量之比=5:4,故C错误;
D.因为S元素的摩尔质量相等,所以S元素的质量之比等于其物质的量之比=5:4,故D错误;
故选A.
点评 本题考查阿伏伽德罗定律及其推论,为高频考点,明确物质的量公式中各个物理量之间的关系是解本题关键,注意公式的灵活运用,题目难度不大.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
7.下列物质与银氨溶液混合加热不会生成银镜的是( )
| A. | 福尔马林溶液 | B. | 麦芽糖 | C. | 蔗糖 | D. | 葡萄糖 |
8.下列物质中属于电解质的是( )
| A. | 盐酸 | B. | 水银 | C. | 胆矾 | D. | 乙醇 |
5.同一系列烷烃,随碳原子数的增加而递减的是( )
| A. | 熔沸点 | B. | 含氢质量分数 | ||
| C. | 液态时密度 | D. | 完全燃烧时耗O2量 |
12.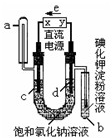 如图是电解饱和氯化钠和氯化铜混合液(滴入酚酞)的装置(电极为惰性电极),一段时间后,试管中溶液变蓝,下列判断中,正确的是( )
如图是电解饱和氯化钠和氯化铜混合液(滴入酚酞)的装置(电极为惰性电极),一段时间后,试管中溶液变蓝,下列判断中,正确的是( )
 如图是电解饱和氯化钠和氯化铜混合液(滴入酚酞)的装置(电极为惰性电极),一段时间后,试管中溶液变蓝,下列判断中,正确的是( )
如图是电解饱和氯化钠和氯化铜混合液(滴入酚酞)的装置(电极为惰性电极),一段时间后,试管中溶液变蓝,下列判断中,正确的是( )| A. | 在电解开始时,a管中有无色气体生成 | |
| B. | x极为阴性 | |
| C. | 在电解开始后,在c极附近颜色变红 | |
| D. | 通电一段时间后,混合液颜色可能变浅 |
8.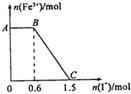 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )
 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )| A. | 图中AB段的氧化剂为K2Cr2O7 | |
| B. | 开始加入的K2Cr2O7为0.25mol | |
| C. | 图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 | |
| D. | K2Cr2O7与FeSO4反应的物质的量之比为1:3 |
12.将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中.然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固.由此可见( )
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应的热化学方程式为:NH4HCO3+HCl═NH4Cl+CO2↑+H2O△H>0 |
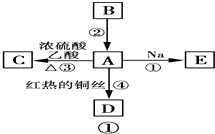 A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示:
A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示: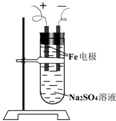 如图所示是用铁作电极,Na2SO4溶液作电解液,制备Fe(OH)2的改进装置.由于阴极产生的H2是还原性气体并且阻止了空气中的氧气进入溶液,所以,可以较长时间地保留Fe(OH)2白色絮状沉淀不变.请写出有关电极反应式:
如图所示是用铁作电极,Na2SO4溶液作电解液,制备Fe(OH)2的改进装置.由于阴极产生的H2是还原性气体并且阻止了空气中的氧气进入溶液,所以,可以较长时间地保留Fe(OH)2白色絮状沉淀不变.请写出有关电极反应式: