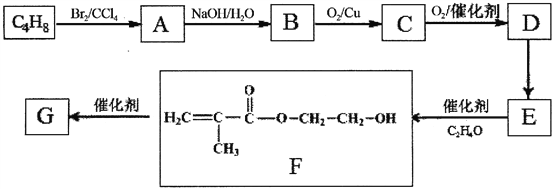
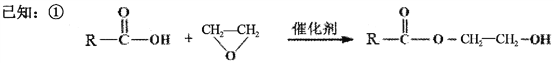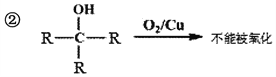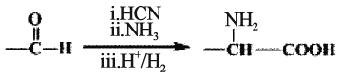题目内容
【题目】氯气溶于水,Cl2约有三分之一与水反应生成盐酸与次氯酸。请回答下列问题:
(1)该可逆反应的离子方程式为__________________。
(2)氯气____溶于饱和食盐水,其原因是增大了上述平衡中的_____浓度,平衡向___反应方向移动。
(3)在上述平衡体系中加入少量NaOH固体,平衡将向______反应方向移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将_______(填“增大”、“减小”或“不变”),平衡将向_______反应方向移动。
【答案】 Cl2+H2O![]() H++Cl-+HClO 难或不 Cl- 逆 正 增大 正
H++Cl-+HClO 难或不 Cl- 逆 正 增大 正
【解析】(1)本题考查氯气与水的反应,氯气与水反应的离子方程式为Cl2+H2O ![]() H++Cl-+HClO;(2)考查影响化学平衡的因素,Cl2+H2O
H++Cl-+HClO;(2)考查影响化学平衡的因素,Cl2+H2O ![]() H++Cl-+HclO,加入饱和食盐水,增加c(Cl-),平衡向逆反应方向移动,因此氯气难溶于饱和食盐水;(3)考查影响化学平衡移动的因素,加入氢氧化钠溶液,OH-+H+=H2O,消耗H+,平衡向正反应方向移动;(4)考查影响化学平衡移动的因素,增大压强,平衡向体积减小的方向进行,即增大压强,平衡向正反应方向移动,氯气在水中的溶解度将增大。
H++Cl-+HclO,加入饱和食盐水,增加c(Cl-),平衡向逆反应方向移动,因此氯气难溶于饱和食盐水;(3)考查影响化学平衡移动的因素,加入氢氧化钠溶液,OH-+H+=H2O,消耗H+,平衡向正反应方向移动;(4)考查影响化学平衡移动的因素,增大压强,平衡向体积减小的方向进行,即增大压强,平衡向正反应方向移动,氯气在水中的溶解度将增大。

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
【题目】除去混合物中的杂质(括号中为杂质),所选试剂和分离方法都正确的是
混合物 | 除杂试剂 | 分离方法 | |
A | 乙烷(乙烯) | Br2(CCl4) | 洗气 |
B | 乙醇(水) | 生石灰 | 过滤 |
C | 硝基苯(HNO3) | NaOH溶液 | 分液 |
D | 溴苯(溴) | CCl4 | 萃取 |
A.AB.BC.CD.D