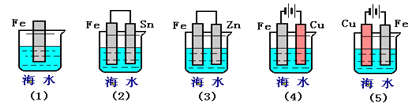
题目内容
【题目】50mL0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。
回答下列问题:

(1)烧杯间填满碎纸条的作用是_____________________,大烧杯上如不盖硬纸板,求得的中和热数值_________(填“偏大”、“偏小”、“无影响”)。
(2)若用浓硫酸与NaOH溶液反应,则测得的中和热的数值会 ________(填“偏大”、“偏小”、“无影响”)。
(3)实验时所用盐酸及NaOH溶液的密度均为1g·cm3,生成溶液的比热容为:c=4.18 kJ·kg-1·℃-1,实验起始温度为t1℃,终止温度为t2℃。试计算生成1mol水时的焓变:△H=________________。
【答案】 防止热量散失 偏小 偏大 △H=-16.72(t2-t1)kJ·mol-1
【解析】试题分析:本题考查中和热的测定,误差分析和数据处理。
(1)烧杯间填满碎纸条的作用是防止热量散失。大烧杯上如不盖硬纸板,将损失较多的热量,求得的中和热数值偏小。
(2)浓硫酸溶于水放热,若用浓硫酸与NaOH溶液反应,则测得的中和热的数值会偏大。
(3)反应中生成n(H2O)=n(HCl)=0.5mol/L![]() 0.05L=0.025mol,反应中放出的热量Q=cmΔt=4.18 kJ·kg-1·℃-1
0.05L=0.025mol,反应中放出的热量Q=cmΔt=4.18 kJ·kg-1·℃-1![]() (1g/cm3
(1g/cm3![]() 50mL+1g/cm3
50mL+1g/cm3![]() 50mL)
50mL)![]() 10-3kg/g(t2-t1)℃=0.418(t2-t1)kJ,生成1molH2O时的焓变ΔH=-
10-3kg/g(t2-t1)℃=0.418(t2-t1)kJ,生成1molH2O时的焓变ΔH=-![]() =-16.72(t2-t1)kJ/mol。
=-16.72(t2-t1)kJ/mol。

 综合自测系列答案
综合自测系列答案【题目】四个电解装置都以Pt作电极,它们分别装着如下电解质溶液进行电解,电解一段时间后,测定其pH变化,所记录的结果正确的是
选项 | A | B | C | D |
电解质溶液pH 变化 | HCl | AgNO3 | KOH | BaCl2 |
pH变化 | 减小 | 增大 | 增大 | 不变 |
A. A B. B C. C D. D