题目内容
在NH4Cl水溶液中用空气氧化碳酸钴(II)可以得到具有光泽的红色氯化物A(NH3:Co:Cl为4:1:1)。将A的固体在0℃下加入用HCl气体饱和的无水乙醇中,在室温下有气体迅速释放,将其振摇至不再有气体发生,得到蓝灰色固体B,B是一种混合物。将B过滤,用乙醇洗涤,然后用少量冷水洗涤, 所得主要产物再经一系列提纯步骤产生紫色晶体C (化学式: CoCl3?4NH3?0.5H2O)。当C在浓盐酸中加热时, 可以分离出一种绿色化合物D, 经分析为CoCl3?4NH3?HCl?H2O。D可溶于冷水,加浓盐酸就沉淀出来。
提示:
① 已知[CoCl2(en)2]+可被拆分的异构体形式是紫色的;并且在溶液中存在如下平衡:
紫色-[CoCl2(en)2]Cl ![]() 绿色-[CoCl2(en)2]Cl?HCl?2H2O
绿色-[CoCl2(en)2]Cl?HCl?2H2O
注:en = H2NCH2CH2NH2
② 在-12℃的低温下,用HCl气体饱和了的盐酸处理如下图所示的双核配合物![]() ,同样能得到C。
,同样能得到C。
回答下列问题:
(1) A~D分别代表何种化合物?请分别画出C与D中配离子的立体结构。
(2) 写出并配平所有的化学方程式。
(3) 试根据C与D中配离子的立体结构判断它们的极性,并简要说明理由。
(4) 用少量冷水洗涤B目的何在?浓盐酸在绿色化合物D形成中起什么作用?
(5) C与D之间的转化属于一种什么类型的反应?
(6) 由题给条件和提示说明你所推测的化学反应发生的依据。 (1)(4分) 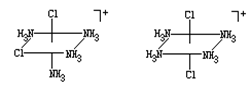
A: [Co(CO3)(NH3)4]Cl;(0.5分) C中配离子的立体结构 D中配离子的立体结构
B: C和D的混合物;(0.5分) (1分) (1分)
C: cis-[CoCl2(NH3)4]Cl?0.5H2O; (0.5分)
D: trans-[CoCl2(NH3)4]Cl?HCl?H2O;(0.5分 )
(2) (3分)
8NH4+ + ![]() O2 + 2CoCO3 = 2[Co(CO3)(NH3)4]+ + 6H+ + H2O (1分)
O2 + 2CoCO3 = 2[Co(CO3)(NH3)4]+ + 6H+ + H2O (1分)
[Co(CO3)(NH3)4]Cl + 2HCl ![]() cis-[CoCl2(NH3)4]Cl?0.5H2O(主产物) +CO2 +
cis-[CoCl2(NH3)4]Cl?0.5H2O(主产物) +CO2 + ![]() H2O (1分)
H2O (1分)
cis-[CoCl2(NH3)4]Cl?0.5H2O + HCl +![]() H2O
H2O![]()
trans-[CoCl2(NH3)4]Cl?HCl?H2O (1分 )
(3) (2分)
由C与D中配离子的立体结构可知,由于前者中各个M―L键的极性不能相互抵消,C中相应的配离子具有极性(1分);而在后者中各个M―L键的极性可相互抵消,D中相应的配离子没有极性(1分)
(4) (1分)
用少量冷水洗涤B是为了除去D (0.5分)
浓盐酸起沉淀剂的作用 (0.5分)
(5) (1分)
C与D之间的转化属于顺-反异构化反应 (1分)
(6) (1分)
答案一:[CoCl2(en)2]+可被拆分的几何异构体形式应为顺式异构体(1分),经类比推测未知紫色化合物C为顺式构型。
或答案二:由题给条件推测紫色化合物在一定温度和浓盐酸条件下容易转化为绿色化合物D(1分) 第(6)题只要写出一种答案即给分。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案下列判断中,正确的是( )
| A.30%和H2O2溶液中加入MnO2可制得O2,MnO2做氧化剂 |
| B.SO2和CO2都属于酸性氧化物,Na2O和Al2O3都属于碱性氧化物[ |
| C.在NH4Cl水溶液中,既存在水解平衡,又存在电离平衡 |
| D.O2在放电条件下生成O3属于化学变化,煤干馏得到焦炭属于物理变化 |