题目内容
6. 有机物A可由葡萄糖发酵得到.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验.
有机物A可由葡萄糖发酵得到.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验.(1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍.试通过计算填空:A的相对分子质量为:90.
(2)将此9.0g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g,则A的分子式为:C3H6O3.
(3)已知A中含羟基和羧基两种官能团,且A的核磁共振氢谱如图:
综上所述,A的结构简式
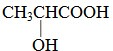 .
.
分析 (1)同温同压下,气体的密度之比等于相对分子质量之比,据此计算;
(2)浓硫酸增重5.4g为水的质量,碱石灰增重13.2g为二氧化碳质量,计算有机物、水、二氧化碳物质的量,进而计算n(H)、n(C),根据质量守恒确定是否含有O元素,根据元素守恒来确定有机物的分子式;
(3)核磁共振氢谱图中有几个峰值则含有几种类型的等效氢原子,峰面积之比等于氢原子的数目之比,结合A的分子式、含有的官能团及核磁共振氢谱书写其结构简式.
解答 解:(1)由其密度是相同条件下H2的45倍,可知A的相对分子质量为:45×2=90,
故答案为:90;
(2)由题意可推知:n(A)=$\frac{9.0g}{90g/mol}$=0.1 mol,硫酸增重5.4gg为水的质量,碱石灰增重13.2g为二氧化碳质量,
n(C)=n(CO2)=$\frac{13.2g}{44g/mol}$=0.3 mol,n(H)=2n(H2O)=2×$\frac{5.4g}{18g/mol}$=0.6 mol,
A分子中含有的C、H元素的总质量为:12g/mol×0.3mol+1g/mol×0.6mol=4.2g<9.0g,说明A分子中还含有O,
则:n(O)=$\frac{9.0g-4.2g}{16g/mol}$=0.3 mol,
所以A中含有的C、H、O原子数分别为:N(C)=$\frac{0.3mol}{0.1mol}$=3、N(H)=$\frac{0.6mol}{0.1mol}$=6、N(O)=$\frac{0.3mol}{0.1mol}$=3,则A的分子式为:C3H6O3,
故答案为:C3H6O3;
(3)核磁共振氢谱中有4个吸收峰,面积之比为1:1:1:3,可知A中应含有4种不同环境的氢原子;又A分子中含有官能团-OH、-COOH,则A的结构简式为: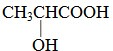 ,
,
故答案为: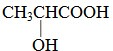 .
.
点评 本题考查有机物分子式、结构简式的确定,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握相对密度、核磁共振氢谱的含义及应用方法.

| A. | 常温下,1 mol•L-1的NH4NO3溶液中含有氮原子的数目为2 NA | |
| B. | 标况下,22.4L氯气通入足量氢氧化钠溶液中充分反应,转移的电子数为NA | |
| C. | 18g D2O和18g H2O中含有的质子数均为10NA | |
| D. | 将100 mL 0.1 mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA |
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
②对反应I,前10min内的平均反应速率v(CH3OH)=0.025mol/(L.min).若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
 图中X是无支链的、具有果香味的合成香料,可用于调配多种果香型香精.已知D在标准状况下的密度为1.25g•L-1,其产量可以用来衡量一个国家石油化工发展水平.E是生活中常见的一种有机物.各物质间转化关系如下:
图中X是无支链的、具有果香味的合成香料,可用于调配多种果香型香精.已知D在标准状况下的密度为1.25g•L-1,其产量可以用来衡量一个国家石油化工发展水平.E是生活中常见的一种有机物.各物质间转化关系如下: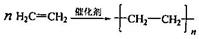 .
.