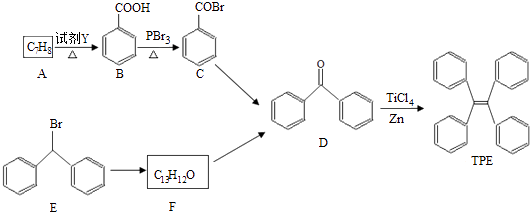
��Ŀ����
����Ŀ�����ӹ�ҵ����30%��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ��������ӡˢ��·�壮�õ��ķ�Һ�к���Fe2+��Cu2+��Fe3+��Cl�� �� Ϊ����ͭ���õ�������FeCl3��Һ���������ۺ����õ���Ҫ���̣� 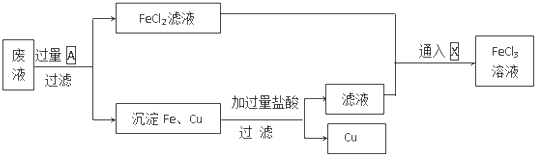
��1��FeCl3��Һ��ͭ��Ӧ�����ӷ���ʽΪ ��
��2����������������A��X�Ļ�ѧʽ��A �� X �� �����������й�Fe2+��Fe3+�ת�������ӷ���ʽ�� ��
���𰸡�
��1��2Fe3++Cu=2Fe2++Cu2+
��2��Fe�� Cl2��2Fe3++Fe=3Fe2+������Cl2+2Fe2+=2 Cl��+2Fe3+
���������⣺�ɹ������̿�֪�������к��н�������ͭ��Ŀ������ȡ�Ȼ�������ҺӦ������������Fe��Ӧ����AΪFe���õ���ҺFeCl2��ͨ��X�������Եõ��Ȼ����������к��н���Cu��δ��Ӧ��Fe������������ᣬ���ˣ�����ͭ����Һ�к���FeCl2����FeCl2��Һ�ϲ����Ʊ��Ȼ�����Һ����1��FeCl3��Һ��ͭ��Ӧ�����Ȼ��������Ȼ�ͭ����Ӧ�����ӷ���ʽΪ��2Fe3++Cu=2Fe2++Cu2+��
���Դ��ǣ�2Fe3++Cu=2Fe2++Cu2+����2������������֪AΪFe��XΪCl2�������������й�Fe2+��Fe3+�ת�������ӷ���ʽ��2Fe3++Fe=3Fe2+��Cl2+2Fe2+=2 Cl��+2Fe3+��
���Դ��ǣ�Fe��Cl2��2Fe3++Fe=3Fe2+�� Cl2+2Fe2+=2 Cl��+2Fe3+��

����Ŀ��ijͬѧ�������ʵ��װ�ý���±�ص�����ʵ�飮��������װ�зֱ���в�ͬ��Һ������Ӧһ��ʱ���ͼ��ָ����λ��ɫ������ȷ���ǣ�������
�� | �� | �� | �� | |
A | ��ɫ | �ȱ��ɫ����ɫ | ��ɫ | ��ɫ |
B | ��ɫ | ��ɫ | ��ɫ | ��ɫ |
C | ��ɫ | ��ɫ | ��ɫ | ��ɫ |
D | ��ɫ | ��ɫ | ��ɫ | ��ɫ |
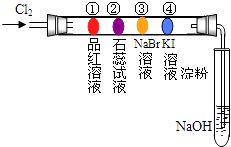
A.A
B.B
C.C
D.D