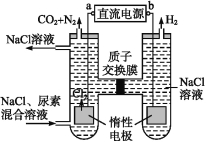
题目内容
【题目】图是中学教材中元素周期表的一部分,其中标出A﹣Q14种元素,试回答下列问题:[(1)(2)问用具体的元素符号或离子符号或化学式回答] 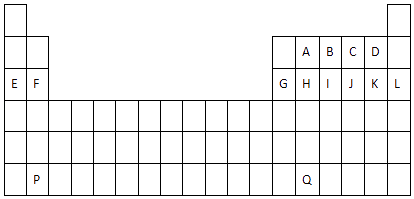
(1)在上表所列出的短周期元素中 ①性质最不活泼的是;②原子半径最大的是(除稀有气体元素)
③形成的气态氢化物最稳定的是;
④最高价氧化物对应的水化物中酸性最强的是碱性最强的是 .
⑤形成的阴离子还原性最弱的是 , 阳离子半径最小的是 .
(2)用电子式表示F与D形成化合物的过程;
(3)设P的原子序数为Z,则F的原子序数为 , Q的原子序数为 .
【答案】
(1)Ar;Na;HF;HClO4;NaOH;F﹣;Al3+
(2)![]()
(3)Z﹣44;Z+26
【解析】解:由元素在周期表中位置,可知A为碳、B为氮、C为O、D为氟、E为Na、F为Mg、G为Al、H为Si、I为磷、J为硫、K为Cl、L为Ar、P为Ba、Q为Pb.(1)①稀有气体原子最外层为稳定结构,故Ar化学性质最不活泼,所以答案是:Ar;②同周期自左而右原子半径减小,同主族自上而下原子半径增大,故上述元素中Na原子半径最小,所以答案是:Na;③同周期自左而右非金属性增强,同主族自上而下非金属性减弱,故上述元素中F的非金属性最强,非金属性越强,氢化物越稳定,故HF最稳定,所以答案是:HF;④最高价氧化物对应的水化物中酸性最强的是高氯酸,化学式为HClO4;最高价氧化物对应的水化物中碱性最强的是高氯酸,化学式为NaOH,所以答案是:HClO4;NaOH;⑤上述元素中F元素非金属性越强,故其阴离子F﹣的还原性最弱;电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故上述元素形成的阳离子中Al3+半径最小,所以答案是:F﹣;Al3+;(2)F与D形成离子化合物为MgF2 , 氟离子和镁离子通过离子键形成离子化合物氟化镁,其形成过程为 ![]() , 所以答案是:
, 所以答案是: ![]() ;(5)F、P同主族,且处于过度元素之前,同主族相邻元素原子序数相差上一周期容纳元素种数,设P的原子序数为Z,则F的原子序数为Z﹣8﹣18﹣18=Z﹣44,P、Q处于第六周期,分别处于2、14列,相差12列,其中该周期第3列容纳15种元素,故Q的原子序数=Z+15+(12﹣1)=Z+26,
;(5)F、P同主族,且处于过度元素之前,同主族相邻元素原子序数相差上一周期容纳元素种数,设P的原子序数为Z,则F的原子序数为Z﹣8﹣18﹣18=Z﹣44,P、Q处于第六周期,分别处于2、14列,相差12列,其中该周期第3列容纳15种元素,故Q的原子序数=Z+15+(12﹣1)=Z+26,
所以答案是:Z﹣44;Z+26.

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案