题目内容
某课外小组利用图1装置在实验室制取SO2并探究其有关性质.
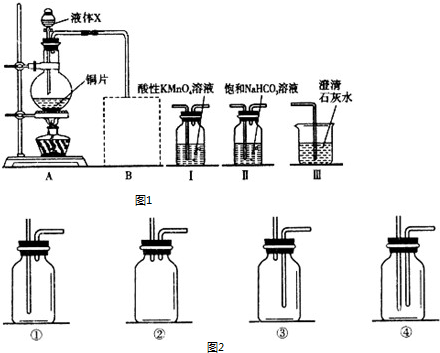
请回答下列问题:
(1)液体X是 .
(2)写出烧瓶中发生反应的化学方程式: .
(3)在图1中虚线框的位置连接有一个安全装置(气体流向从左至右),可以选用图2装置中的 (填写序号).
(4)SO2溶于水后生成亚硫酸,为了验证酸性:H2SO3>H2CO3,则图2中装置Ⅰ、Ⅱ、Ⅲ的正确连接顺序是 接 接 (用Ⅰ、Ⅱ、Ⅲ填空).
(5)按(4)中连接顺序进行实验,证明酸性H2SO3>H2CO3的现象是 ,KMnO4溶液的作用是 .
(6)我国工业上SO2是利用黄铁矿在 (填设备名称)中高温煅烧制得的.请计算煅烧1t含FeS2的质量分数为60%的黄铁矿矿石在理论上能生产多少吨浓度为98%的硫酸?(设生产过程中共损失硫2%)(要求写必要的计算过程) .

请回答下列问题:
(1)液体X是
(2)写出烧瓶中发生反应的化学方程式:
(3)在图1中虚线框的位置连接有一个安全装置(气体流向从左至右),可以选用图2装置中的
(4)SO2溶于水后生成亚硫酸,为了验证酸性:H2SO3>H2CO3,则图2中装置Ⅰ、Ⅱ、Ⅲ的正确连接顺序是
(5)按(4)中连接顺序进行实验,证明酸性H2SO3>H2CO3的现象是
(6)我国工业上SO2是利用黄铁矿在
分析:(1)A装置是二氧化硫的发生装置,所以圆底烧瓶内的液体是浓硫酸;
(2)烧瓶中Cu与浓硫酸反应生成二氧化硫、硫酸铜和水;
(3)为了防止液体倒吸进入反应装置,进入安全瓶的导管不能伸入瓶底;
(4)要验证酸性:H2SO3>H2CO3,则二氧化硫应该先通入NaHCO3溶液,然后用KMnO4溶液吸收多余的二氧化硫,最后用澄清石灰水检验二氧化碳;
(5)证明酸性H2SO3>H2CO3,二氧化硫与NaHCO3溶液反应后必须被KMnO4溶液完全吸收,证明有二氧化碳,则根据澄清石灰水中现象分析;用KMnO4溶液吸收多余的二氧化硫,因为二氧化硫也能使澄清石灰水变浑浊;
(6)工业上SO2是利用黄铁矿在沸腾炉中高温煅烧制得的;根据化学反应方程式;利用硫元素守恒计算.
(2)烧瓶中Cu与浓硫酸反应生成二氧化硫、硫酸铜和水;
(3)为了防止液体倒吸进入反应装置,进入安全瓶的导管不能伸入瓶底;
(4)要验证酸性:H2SO3>H2CO3,则二氧化硫应该先通入NaHCO3溶液,然后用KMnO4溶液吸收多余的二氧化硫,最后用澄清石灰水检验二氧化碳;
(5)证明酸性H2SO3>H2CO3,二氧化硫与NaHCO3溶液反应后必须被KMnO4溶液完全吸收,证明有二氧化碳,则根据澄清石灰水中现象分析;用KMnO4溶液吸收多余的二氧化硫,因为二氧化硫也能使澄清石灰水变浑浊;
(6)工业上SO2是利用黄铁矿在沸腾炉中高温煅烧制得的;根据化学反应方程式;利用硫元素守恒计算.
解答:解:(1)A装置是二氧化硫的发生装置,所以圆底烧瓶内是Cu与浓硫酸,所以液体X是浓硫酸,故答案为:浓硫酸;
(2)烧瓶中Cu与浓硫酸反应生成二氧化硫、硫酸铜和水,其反应方程式为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;
(3)为了防止液体倒吸进入反应装置,从反应装置进入安全瓶的导管不能伸入安全瓶瓶底,所以可以选用②③,故答案为:②③;
(4)要验证酸性:H2SO3>H2CO3,则二氧化硫应该先通入NaHCO3溶液,然后用KMnO4溶液吸收多余的二氧化硫,最后用澄清石灰水检验二氧化碳,则仪器链接顺序为:Ⅱ、Ⅰ、Ⅲ,故答案为:Ⅱ;Ⅰ;Ⅲ;
(5)证明酸性H2SO3>H2CO3,二氧化硫与NaHCO3溶液反应后必须被KMnO4溶液完全吸收,则KMnO4溶液的紫色不完全褪去,证明有二氧化碳,则澄清石灰水变浑浊;用KMnO4溶液吸收多余的二氧化硫,因为二氧化硫也能使澄清石灰水变浑浊,会干扰二氧化碳的检验,所以KMnO4溶液的作用:是除去未反应的SO2,防止其干扰CO2的检验,
故答案为:KMnO4溶液的紫色不完全退去,澄清石灰水变混浊;除去未反应的SO2,防止其干扰CO2的检验;
(6)工业上SO2是利用黄铁矿在沸腾炉中高温煅烧制得的;
根据反应前后硫元素质量不变,即硫元素守恒思想可列等式进行计算,设生成98%的硫酸的质量为xt,
则:FeS2 ~2H2SO4
120 98×2
1t×60%×(1-2%) xt×98%
所以
=
,解得x=0.98t
故答案为:沸腾炉;0.98t.
(2)烧瓶中Cu与浓硫酸反应生成二氧化硫、硫酸铜和水,其反应方程式为:Cu+2H2SO4(浓)
| ||
故答案为:Cu+2H2SO4(浓)
| ||
(3)为了防止液体倒吸进入反应装置,从反应装置进入安全瓶的导管不能伸入安全瓶瓶底,所以可以选用②③,故答案为:②③;
(4)要验证酸性:H2SO3>H2CO3,则二氧化硫应该先通入NaHCO3溶液,然后用KMnO4溶液吸收多余的二氧化硫,最后用澄清石灰水检验二氧化碳,则仪器链接顺序为:Ⅱ、Ⅰ、Ⅲ,故答案为:Ⅱ;Ⅰ;Ⅲ;
(5)证明酸性H2SO3>H2CO3,二氧化硫与NaHCO3溶液反应后必须被KMnO4溶液完全吸收,则KMnO4溶液的紫色不完全褪去,证明有二氧化碳,则澄清石灰水变浑浊;用KMnO4溶液吸收多余的二氧化硫,因为二氧化硫也能使澄清石灰水变浑浊,会干扰二氧化碳的检验,所以KMnO4溶液的作用:是除去未反应的SO2,防止其干扰CO2的检验,
故答案为:KMnO4溶液的紫色不完全退去,澄清石灰水变混浊;除去未反应的SO2,防止其干扰CO2的检验;
(6)工业上SO2是利用黄铁矿在沸腾炉中高温煅烧制得的;
根据反应前后硫元素质量不变,即硫元素守恒思想可列等式进行计算,设生成98%的硫酸的质量为xt,
则:FeS2 ~2H2SO4
120 98×2
1t×60%×(1-2%) xt×98%
所以
| 120 |
| 1t×60%×(1-2%) |
| 98×2 |
| xt×98% |
故答案为:沸腾炉;0.98t.
点评:本题考查了二氧化硫、二氧化碳的性质,涉及试剂的选择、方程式的书写、气体的检验,根据方程式的计算等,考查知识点较多,难度中等.

练习册系列答案
相关题目
 某课外兴趣小组为探究某种铝合金(含Mg Al)中铝含量,设计如图装置进行实验.
某课外兴趣小组为探究某种铝合金(含Mg Al)中铝含量,设计如图装置进行实验.

 Ⅱ.某课外活动小组利用如图装
Ⅱ.某课外活动小组利用如图装