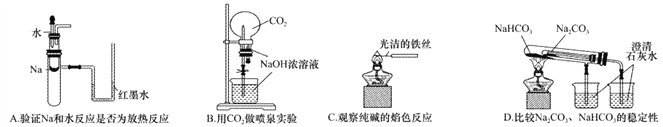
题目内容
【题目】标准状况下,某同学向100mLH2S饱和溶液中通入SO2 , 所得溶液pH变化如图所示,下列分析中,正确的是( ) 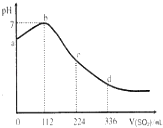
A.b 点对应的溶液导电性最强
B.亚硫酸是比氧硫酸更弱的酸
C.原H2S溶液的物质的量浓度为0.05molL﹣1
D.ab段反应是:SO2+2H2S═3S↓+2H2O
【答案】D
【解析】解:A.b点为中性,只有水,导电性最差,故A错误;
B.根据图象可知恰好反应时消耗二氧化硫112mL,n(SO2)= ![]() =0.005mol,根据方程式可知原溶液中硫化氢为0.01mol,通入336mL二氧化硫时,溶液中亚硫酸为0.01mol,亚硫酸的浓度与原氢硫酸浓度相等,二者都是二元酸,溶液中亚硫酸pH值更小,故亚硫酸的酸性比氢硫酸更强,故B错误;
=0.005mol,根据方程式可知原溶液中硫化氢为0.01mol,通入336mL二氧化硫时,溶液中亚硫酸为0.01mol,亚硫酸的浓度与原氢硫酸浓度相等,二者都是二元酸,溶液中亚硫酸pH值更小,故亚硫酸的酸性比氢硫酸更强,故B错误;
C.由图可知,112mLSO2与硫化氢恰好完全反应,则n(SO2)= ![]() =0.005mol,由方程式可知n(H2S)=0.01mol,则原H2S溶液的物质的量浓度为
=0.005mol,由方程式可知n(H2S)=0.01mol,则原H2S溶液的物质的量浓度为 ![]() =0.1mol/L,故C错误.
=0.1mol/L,故C错误.
D.ab段pH在增大,由酸性到中性,则发生的反应是SO2+2H2S=3S↓+2H2O,故D正确;
故选D.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.

练习册系列答案
相关题目