题目内容
【题目】中科院一项新研究成果实现了甲烷高效生产乙烯,其反应为:2CH4(g)![]() C2H4(g)+2H2(g) ΔH>0
C2H4(g)+2H2(g) ΔH>0
物质 | 燃烧热(kJ/mol) |
氢气 | 285.8 |
甲烷 | 890.3 |
乙烯 | 1411.5 |
(1)已知相关物质的燃烧热如表,完成热化学方程式:2CH4(g)![]() C2H4(g)+2H2(g) ΔH=__。
C2H4(g)+2H2(g) ΔH=__。
(2)温度为T1℃时,向1 L的恒容反应器中充入2 mol CH4,仅发生上述反应,反应0~15 min CH4的物质的量随时间变化如图1,实验测得10~15 min时H2的浓度为1.6 mol/L。

①若图1中曲线a、b分别表示在T1℃时,使用等质量的两种不同的催化剂时,达到平衡过程中n(CH4)变化曲线,判断:催化剂a_____b(填“优于”或“劣于”)。
②在15 min时改变反应条件,导致n(CH4)发生变化(见图1),则改变的条件可能是:_____(任答一条即可)。
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),其中k正、k逆为速率常数仅与温度有关,温度为![]() 时,k正与k逆的比值为______(填数值)。若将温度由T1升高到T2,则反应速率增大的倍数v正_______ v逆(填“>”、“=”或“<”),判断的理由是_________。
时,k正与k逆的比值为______(填数值)。若将温度由T1升高到T2,则反应速率增大的倍数v正_______ v逆(填“>”、“=”或“<”),判断的理由是_________。
(4)科研人员设计了甲烷燃料电池并用于电解(如图2)。电解质是掺杂了Y2O3与ZrO2的固体,可在高温下传导O2-。
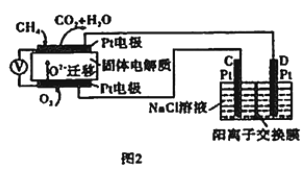
①图中C处的Pt为_______(填“阴”或“阳”)极。
②该电池工作时负极的电极反应式为________。
③用该电池电解饱和食盐水,一段时间后收集到标准状况下气体总体积为112 mL,则阴极区所得溶液在25℃时pH=_______(假设电解前后NaCl溶液的体积均为500 mL)。
【答案】+202.5 kJ/mol 劣于 升高温度或减小压强 12.8 > 升高温度,正、逆反应速率都加快,平衡正向移动,v(正)>v(逆),说明正反应速率增大的倍数多于逆反应速率增大的倍数 阳 CH4-8e-+4O2-=CO2+2H2O 12
【解析】
(1)根据已知条件,可得热化学方程式:
①H2(g)+![]() O2(g)=H2O(l) ;ΔH=-285.8 kJ/mol;
O2(g)=H2O(l) ;ΔH=-285.8 kJ/mol;
②CH4(g)+2O2(g)=CO2(g)+2H2O(l); ΔH=-890.3 kJ/mol;
③C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ;ΔH=-1411.5kJ/mol;
根据盖斯定律,将②×2-①×2-③,整理可得:2CH4(g)![]() C2H4(g)+2H2(g) ΔH=+202.5 kJ/mol;
C2H4(g)+2H2(g) ΔH=+202.5 kJ/mol;
(2)①若图1中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(CH4)变化曲线,可知:b催化剂表面积大,反应速率越快,达到平衡所需时间越短,先达到平衡,该催化剂性能好,b先达到平衡,说明催化剂a劣于催化剂b;
②15 min时,若改变外界反应条件,n(CH4)发生图中所示变化,物质的量随时间变化减小,说明平衡正向进行,正反应为气体体积增大的吸热反应,升高温度或减小压强,平衡正向进行,符合图象变化,故改变的条件是升高温度或减小压强;
(3) v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2),其中k正、k逆为速率常数仅与温度有关,温度不变平衡常数不变,反应达到平衡状态时,正、逆反应速率相同,得到T1温度时k正与k逆的比值;k正c2(CH4)=k逆c(C2H4)·c2(H2),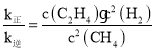 ,对于反应2CH4(g)
,对于反应2CH4(g)![]() C2H4(g)+2H2(g) ,反应开始时n(CH4)=2 mol,n(C2H4)=n(H2)=0,反应达到平衡时,H2的浓度为1.6 mol/L,由于容器的容积是1 L,所以平衡时气体的物质的量与浓度数值相等,各种物质的平衡浓度分别是:c(CH4)=(2 -1.6)mol/L=0.4 mol/L,n(C2H4)=0.8 mol/L,n(H2)=1.6 mol/L,因此平衡时K=
C2H4(g)+2H2(g) ,反应开始时n(CH4)=2 mol,n(C2H4)=n(H2)=0,反应达到平衡时,H2的浓度为1.6 mol/L,由于容器的容积是1 L,所以平衡时气体的物质的量与浓度数值相等,各种物质的平衡浓度分别是:c(CH4)=(2 -1.6)mol/L=0.4 mol/L,n(C2H4)=0.8 mol/L,n(H2)=1.6 mol/L,因此平衡时K=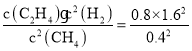 mol/L=12.8 mol/L,即
mol/L=12.8 mol/L,即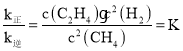 =12.8 mol/L;升高温度,正、逆反应速率都加快。由于该反应的正反应为吸热反应,根据平衡移动原理:升高温度,平衡向吸热反应方向移动,说明正反应速率增大的倍数大于逆反应速率增大的倍数,速率增大后,由于v(正)>v(逆),使化学平衡正向移动;
=12.8 mol/L;升高温度,正、逆反应速率都加快。由于该反应的正反应为吸热反应,根据平衡移动原理:升高温度,平衡向吸热反应方向移动,说明正反应速率增大的倍数大于逆反应速率增大的倍数,速率增大后,由于v(正)>v(逆),使化学平衡正向移动;
(4)①甲烷燃料电池中通入甲烷的电极为原电池负极,通入氧气的电极为原电池的正极,C极与原电池的正极连接为阳极;
②在原电池负极,CH4失去电子生成CO2,传导离子是O2-,结合电荷守恒、原子守恒,可得负极的电极反应式:CH4-8e-+4O2-=CO2+2H2O;
③n(H2+Cl2)=![]() =0.005 mol,根据电解反应方程式:2NaCl+2H2O
=0.005 mol,根据电解反应方程式:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,可知每反应产生2 mol气体,同时在阴极得到2 mol NaOH,现在反应产生0.005 mol气体,因此反应产生了0.005 mol NaOH,由于溶液的体积是0.5 L,则阴极附近溶液中c(NaOH)=
Cl2↑+H2↑+2NaOH,可知每反应产生2 mol气体,同时在阴极得到2 mol NaOH,现在反应产生0.005 mol气体,因此反应产生了0.005 mol NaOH,由于溶液的体积是0.5 L,则阴极附近溶液中c(NaOH)=![]() =0.01 mol/L,在室温下水的离子积常数Kw=10-14(mol/L)2,c(H+)=
=0.01 mol/L,在室温下水的离子积常数Kw=10-14(mol/L)2,c(H+)=![]() mol/L=10-12 mol/L,所以溶液的pH=12。
mol/L=10-12 mol/L,所以溶液的pH=12。

 阅读快车系列答案
阅读快车系列答案【题目】一定量的铁粉在氯气中充分燃烧后,将所得固体完全溶于稀盐酸,制得溶液A。
(1)铁在氯气中燃烧的化学方程式是____________________________。
(2)推测A中可能含有的金属阳离子:①Fe3+;②只有Fe2+;③______。
甲同学为探究溶液的组成,实验如下:
实验步骤 | 实验现象 | 实验结论及反应离子方程式 |
取少量溶液A于试管中,加入KSCN溶液。 | ________ | 假设②不成立,假设①或③成立;反应的离子方程式是_____________ 。 |
(3)乙同学继续探究溶液A的组成。
查阅资料:16HCl+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O
实验过程:另取少量溶液A于试管中,逐滴加入酸性KMnO4溶液,充分振荡,KMnO4紫色褪去。
实验结论:__________(填写字母序号)。
a.可能有Fe2+ b.可能无Fe2+ c.一定有Fe2+
(4)结论:A中含有的阳离子是_________,简述理由:________________。