题目内容
【题目】25℃时,用0.10 mol L-1的氨水滴定10.00 mL a mol L-1的盐酸,溶液的pH与氨水的体积(V)的关系如图所示。已知:N点溶液中存在:c(H+)=c(OH-)+c(NH3·H2O),下列说法正确的是
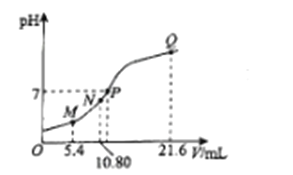
A. M点溶液中存在:c(H+)=c(OH-)+2c(NH3·H2O)+ c(NH4+)
B. N、Q两点溶液中NH3 H2O的电离常数:N<Q
C. P 点氨水过量,c(NH4+)> c(Cl-)
D. a=0.054
【答案】A
【解析】N点溶液中存在的电荷守恒式为c(H+)+c(NH4+)=c(OH-)+c(Cl-) ,已知c(H+)=c(OH-)+c(NH3·H2O),则c(NH3·H2O)+c(NH4+)=c(Cl-) 可知此时溶液中只有NH4Cl,即滴加氨水10.8mL时恰好完全中和,所得溶液为NH4Cl;A.M点滴加氨水为5.4mL 完全反应后溶液为HCl和NH4Cl等浓度的混合溶液,存在的电荷守恒式为c(H+)+c(NH4+)=c(OH-)+c(Cl-) ,若c(H+)=c(OH-)+2c(NH3·H2O)+ c(NH4+),则2c(NH3·H2O)+ 2c(NH4+)=c(Cl-) ,满足物料守恒,故A正确;B.NH3 H2O的电离常数只随温度变化而变化,恒温下电离平衡常数不变,即N=Q,故B错误;C.P 点氨水过量,此时溶液显中性,即c(H+)=c(OH-) ,根据电荷守恒式c(H+)+c(NH4+)=c(OH-)+c(Cl-) 可知,c(NH4+)= c(Cl-),故C错误;D.N点恰好完全中和,则0.10 mol L-1×10.8mL=10.00 mL× a mol L-1,a=0.108,故D错误;答案为A。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验操作和现象与所得结论一定正确的是
选项 | 操作 | 现象 | 结论 |
A. | 向黄色的Fe(NO)3溶液中滴加氢碘酸 | 溶液变为紫红色 | 氧化性:Fe3+>I2 |
a | 向某无色溶液中滴加稀盐酸,将产生的无色气体通入品红溶液 | 品红溶液褪色 | 原溶液中含有SO32- |
C. | 向Mg2+和Cu2+共存的溶液中滴加适量NaOH溶液,过滤、洗涤 | 得到白色沉淀 | 相同温度下,溶度积常数: Ksp[Mg(OH)2]<Ksp[Cu(OH)2] |
D. | 一定温度下,向K2Co2O7溶液中加入少量KOH | 溶液橙色变浅 | 减小H+浓度,Co2O72-+H2O 2CrO42-+2H+的平衡正向移动 |
A. A B. B C. C D. D