题目内容
下列叙述与对应图式正确的是
A.由下列短周期元素性质的数据推断元素③最高价氧化物对应的水化物碱性最强

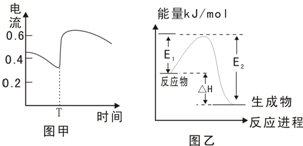
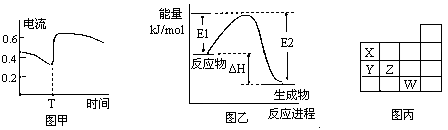
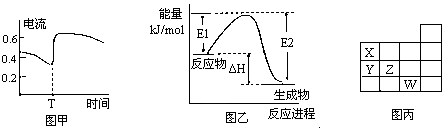
B.图甲表示Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了H2O2

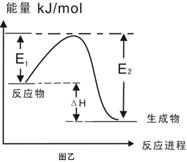
C.图乙表示某一放热反应,若使用催化剂E1、E2、ΔH都会发生改变
D.表示H2燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H= -571.6kJ/mol
【答案】
B
【解析】
试题分析:A、根据同主族自上而下,原子半径逐渐增大可知,③是Li,⑥是Na,所以⑥最高价氧化物对应的水化物碱性最强,A不正确;B、双氧水具有强氧化性,能加快反应速率,所以电流强度增大,B正确;C、催化剂只能改变活化能,但不能改变反应热,C不正确;D、燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以表示H2燃烧热的热化学方程式为H2(g)+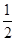 O2(g)=H2O(l) △H=-285.8kJ/mol,D不正确,答案选B。
O2(g)=H2O(l) △H=-285.8kJ/mol,D不正确,答案选B。
考点:考查元素周期律的应用;外界条件对反应速率和反应热的影响;燃烧热和热化学方程式的有关判断

练习册系列答案
相关题目
下列叙述与对应图式正确的是( )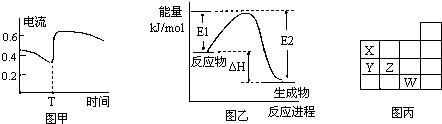

A、由下列短周期元素性质的数据推断元素③最高价氧化物对应的水化物碱性最强
| |||||||||||||||||||||||||||
| B、图甲表示Zn-Cu原电池反应过程中的电流强度的变化.T时可能加入了H2O2 | |||||||||||||||||||||||||||
| C、图乙表示某一放热反应,若使用催化剂E1、E2、△H都会发生改变 | |||||||||||||||||||||||||||
| D、图丙表示元素周期表的一部分,元素X,Y,Z、W中X的氢化物酸性最强 |