题目内容
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A pH=4的醋酸中:c(H+)=4.0molL-1
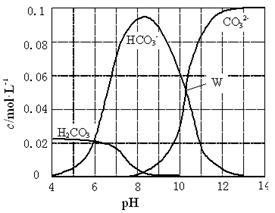
B 饱和小苏打溶液中:c(Na+)= c(HCO3-)
C 饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-)
D pH=12的纯碱溶液中:c(OH-)=1.0×10-2molL-1
A pH=4的醋酸中:c(H+)=4.0molL-1
B 饱和小苏打溶液中:c(Na+)= c(HCO3-)
C 饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-)
D pH=12的纯碱溶液中:c(OH-)=1.0×10-2molL-1
D
A中c(H+)=10-4mol/L,不是4mol/L,A错;HCO3-+H2O H2CO3-+OH-、HCO3-
H2CO3-+OH-、HCO3- CO32-+H+,根据钠元素与碳元素间的关系得,c(Na+)=c(HCO3-)+(H2CO3)+c(CO32-),B错。根据饱和食盐水中离子的种类及电荷守恒关系知,C正确。25℃时,pH=12的纯碱溶液中,c(OH-)=10-2mol/L,所以D错。答案选C。
CO32-+H+,根据钠元素与碳元素间的关系得,c(Na+)=c(HCO3-)+(H2CO3)+c(CO32-),B错。根据饱和食盐水中离子的种类及电荷守恒关系知,C正确。25℃时,pH=12的纯碱溶液中,c(OH-)=10-2mol/L,所以D错。答案选C。
 H2CO3-+OH-、HCO3-
H2CO3-+OH-、HCO3- CO32-+H+,根据钠元素与碳元素间的关系得,c(Na+)=c(HCO3-)+(H2CO3)+c(CO32-),B错。根据饱和食盐水中离子的种类及电荷守恒关系知,C正确。25℃时,pH=12的纯碱溶液中,c(OH-)=10-2mol/L,所以D错。答案选C。
CO32-+H+,根据钠元素与碳元素间的关系得,c(Na+)=c(HCO3-)+(H2CO3)+c(CO32-),B错。根据饱和食盐水中离子的种类及电荷守恒关系知,C正确。25℃时,pH=12的纯碱溶液中,c(OH-)=10-2mol/L,所以D错。答案选C。
练习册系列答案
相关题目
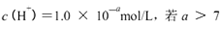 时,则该溶液的pH一定为14-a
时,则该溶液的pH一定为14-a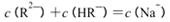
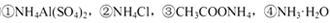 溶液中,c (NH4+)由大到小的顺序是:①>②>③>④
溶液中,c (NH4+)由大到小的顺序是:①>②>③>④ NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入适量的物质是:①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥加入少量MgSO4固体
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入适量的物质是:①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥加入少量MgSO4固体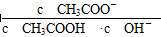 不变
不变