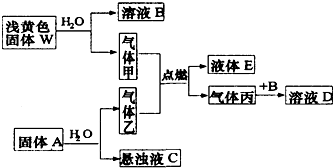
题目内容
2.乙烯是石油裂解的主要产物之一,是重要的化工原料,它的年产量标志作国家有机化工发展的水平.将乙烯通入足量溴的四氯化碳溶液中,充分反应,其反应方程式为Br2+CH2=CH2→BrCH2-CH2Br乙烯在一定条件下发生加聚反应的化学方程式是nCH2═CH2$\stackrel{催化剂}{→}$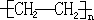 ,乙烯对水果具有催熟功能.
,乙烯对水果具有催熟功能.
分析 乙烯含碳碳双键,能够与溴发生加成反应;能够发生加成聚合反应生成聚乙烯;乙烯对水果具有催熟功能.
解答 解:乙烯含碳碳双键,能够与溴发生加成反应,使溴的四氯化碳溶液褪色,反应的方程式为:CH2=CH2+Br2→CH2BrCH2Br;
乙烯含有碳碳双键,在引发剂的条件下发生加成聚合反应生成聚乙烯,方程式为nCH2═CH2$\stackrel{催化剂}{→}$ ;
;
乙烯对水果具有催熟功能;
故答案为:Br2+CH2=CH2→BrCH2-CH2Br;nCH2═CH2$\stackrel{催化剂}{→}$ ;催熟.
;催熟.
点评 本题考查有机物的结构和性质,为高频考点,题目侧重考查乙烯的性质,属于对课本基础知识的考查,明确乙烯的结构是解题关键,题目难度不大

练习册系列答案
相关题目
17.下列各组物质间反应,其中水既不作氧化剂又不作还原剂的氧化还原反应是( )
①F2和H2O ②Na和H2O ③Na2O2和H2O ④P2O5和H2O⑤NaH和H2O ⑥Cl2和H2O ⑦NO2和H2O.
①F2和H2O ②Na和H2O ③Na2O2和H2O ④P2O5和H2O⑤NaH和H2O ⑥Cl2和H2O ⑦NO2和H2O.
| A. | ①⑤⑦ | B. | ③④⑤⑥⑦ | C. | ③⑥⑦ | D. | ②③⑤ |
7.可用如图装置制取(必要时可加热)和收集的气体是( )
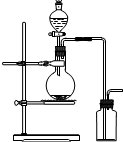

| A. | 氯酸钾溶液与二氧化锰反应制氧气 | B. | 浓氨水与氢氧化钙固体制氨气 | ||
| C. | 乙醇和浓硫酸(170℃)制乙烯 | D. | 铜和浓硝酸制二氧化氮 |
11.下列实验操作不正确或不能达到目的是( )
| A. |  鉴别碳酸钠和碳酸氢钠 | |
| B. |  钠的燃烧 | |
| C. | 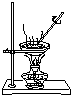 直接蒸发氯化铁溶液获得氯化铁晶体 | |
| D. |  实验室制取蒸馏水 |

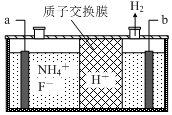 在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示.
在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如图所示.
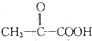 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +CO2↑
+CO2↑ $→_{△}^{NaOH(aq)}$
$→_{△}^{NaOH(aq)}$ +H2O
+H2O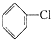 $→_{(Ⅱ)H+}^{(Ⅰ)_{10}%NaOH;Cu}$
$→_{(Ⅱ)H+}^{(Ⅰ)_{10}%NaOH;Cu}$
 +CH3COCH2COCH3$→_{△}^{NaOH(aq)}$
+CH3COCH2COCH3$→_{△}^{NaOH(aq)}$ +2H2O.
+2H2O.