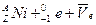题目内容
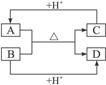
A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p亚层中有3个电子。
⑴C原子的电子排布式为_______,若A元素的原子最外层电子排布为1s1,则A与C按个数比1:1形成的化合物的电子式__________。
⑵当n=2时,B的原子结构示意图为________,B与C形成的化合物的结构式为___________。
⑶若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,元素A在周期表中的位置是__________,A、B、C、D四种元素的第一电离能由大到小的顺序是 _____________________(用元素符号表示)。
⑴C原子的电子排布式为_______,若A元素的原子最外层电子排布为1s1,则A与C按个数比1:1形成的化合物的电子式__________。
⑵当n=2时,B的原子结构示意图为________,B与C形成的化合物的结构式为___________。
⑶若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,元素A在周期表中的位置是__________,A、B、C、D四种元素的第一电离能由大到小的顺序是 _____________________(用元素符号表示)。
⑴1s22s22p4 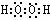 ⑵
⑵  O=C=O
O=C=O
⑶第二周期IA族;O>P>Si>Li
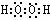 ⑵
⑵ 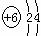 O=C=O
O=C=O⑶第二周期IA族;O>P>Si>Li
A可能为H、Li、Na三种元素的任一种,B可能为C、Si中的一种,C为O,电子排布式为1s22s22p4,D的电子排布式为1s22s22p63s23p3,为P。
⑴当A电子排布式为1s1时,为氢元素,与O形成H2O2;
⑵n=2,
B为C,其原子结构示意图为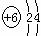 ;
;
⑶A为Li,B为Si,则四者在周期表中位置关系为
第一电离能顺序为I1(O)> I1(P)> I1(Si)> I1(Li)
⑴当A电子排布式为1s1时,为氢元素,与O形成H2O2;
⑵n=2,
| Li | | | | | O |
| | | | Si | P | |
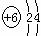 ;
;⑶A为Li,B为Si,则四者在周期表中位置关系为
第一电离能顺序为I1(O)> I1(P)> I1(Si)> I1(Li)

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 放射源进行了实验验证。次年,杨振宁、李政道两人因此获得诺贝尔物理奖。
放射源进行了实验验证。次年,杨振宁、李政道两人因此获得诺贝尔物理奖。