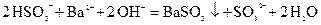题目内容
(12分)某强碱性溶液中可能含有的离子是K+、NH4+、Al3+、HCO3-、AlO2-、SO42-、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成.
②另取少量溶液逐滴加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶液中肯定存在的离子是 ,肯定不存在的 离子是 ,不能确定的离子是 ,其检验方法是
离子是 ,不能确定的离子是 ,其检验方法是
。
(2)按照反应顺序逐步书写出②中发生反应的离子反应方程式①H++OH-=H2O
② 。
③ 。
④HCO3-+H+=H2O+CO2↑
⑤ 。
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成.
②另取少量溶液逐滴加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶液中肯定存在的离子是 ,肯定不存在的
 离子是 ,不能确定的离子是 ,其检验方法是
离子是 ,不能确定的离子是 ,其检验方法是 。
(2)按照反应顺序逐步书写出②中发生反应的离子反应方程式①H++OH-=H2O
② 。
③ 。
④HCO3-+H+=H2O+CO2↑
⑤ 。
12分)
(1)OH-、AlO2-、CO32-、K+;(2分)
NH4+、SO42-、HCO3-、Al3+;(2分)
Cl-;取原溶液加入足量的硝酸酸化,再加入硝酸银溶液,有白色沉淀生成则有Cl -,否则没有。(各1分,共2分)
-,否则没有。(各1分,共2分)
(2) AlO2- + H++H2O = Al(OH) 3 ↓ CO32-+H+=HCO3- Al(OH) 3 +3H+=3H2O+Al3+(各2分,共6分
(1)OH-、AlO2-、CO32-、K+;(2分)
NH4+、SO42-、HCO3-、Al3+;(2分)
Cl-;取原溶液加入足量的硝酸酸化,再加入硝酸银溶液,有白色沉淀生成则有Cl
 -,否则没有。(各1分,共2分)
-,否则没有。(各1分,共2分)(2) AlO2- + H++H2O = Al(OH) 3 ↓ CO32-+H+=HCO3- Al(OH) 3 +3H+=3H2O+Al3+(各2分,共6分
略

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 I2+2OH-
I2+2OH-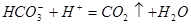
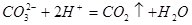
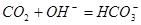
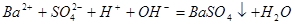
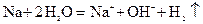
 通入
通入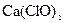 溶液中:
溶液中: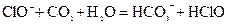
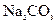 溶液中加入过量
溶液中加入过量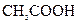 溶液:
溶液: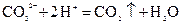
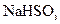 溶液:
溶液: