题目内容
 工业上冶炼冰铜(mCu2O?nFeS)可得到粗铜,再以粗铜为原料制备硫酸铜晶体.
工业上冶炼冰铜(mCu2O?nFeS)可得到粗铜,再以粗铜为原料制备硫酸铜晶体.
完成下列填空:
(1)气体A中的大气污染物可选用下列试剂中的
cd
cd
(填序号)吸收.a.浓H2SO4 b.浓HNO3
c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加
硫氰化钾
硫氰化钾
(填物质名称)溶液后呈红色,说明溶液中存在Fe3+,检验溶液中还存在Fe2+的方法是另取少量溶液,滴加几滴高锰酸钾的酸性溶液,紫色褪去,说明溶液中存在Fe2+
另取少量溶液,滴加几滴高锰酸钾的酸性溶液,紫色褪去,说明溶液中存在Fe2+
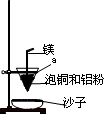
(注明试剂、现象).实验室可用如图的装置完成泡铜冶炼粗铜的反应.(3)泡铜冶炼粗铜的化学方程式是
3Cu2O+2Al
6Cu+Al2O3
| ||
3Cu2O+2Al
6Cu+Al2O3
.
| ||
(4)装置中镁带的作用是
燃烧放出大量的热,创造高温环境(或引燃剂)
燃烧放出大量的热,创造高温环境(或引燃剂)
.泡铜和铝粉混合物表面覆盖少量白色固体a,a是氯酸钾
氯酸钾
(填名称).沙子能否换成水?不能
不能
(填“能”或“不能”).(5)用滴定法测定CuSO4?5H2O的含量.取a g试样配成100mL溶液,取20.00mL用c mol/L (H2Y2-,滴定剂不与杂质反应)滴定至终点,消耗滴定剂bmL滴定反应:Cu2++H2Y2-?
| 滴定剂 |
| 5bc |
| 4a |
| 5bc |
| 4a |
(6)下列操作会导致CuSO4?5H2O含量的测定结果偏高的是
c
c
.a.滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准液至锥形瓶中
b.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定
c.滴定前,滴定管尖端有气泡,滴定后气泡消失.
分析:(1)气体A为SO2,可用碱液吸收;
(2)检验溶液中存在Fe3+,可用KSCN,Fe2+具有还原性,可用酸性高锰酸钾溶液检验;
(3)Cu2O与Al在高温下反应生成Cu和Al2O3,为铝热反应;
(4)镁带起到引燃作用,用氯酸钾作助燃剂,生成氧气,有利于镁的燃烧;
(5)计算n(Cu2+),可计算出CuSO4?5H2O的质量,进而计算质量分数;
(6)导致CuSO4?5H2O含量的测定结果偏高,应使滴定液的体积偏大.
(2)检验溶液中存在Fe3+,可用KSCN,Fe2+具有还原性,可用酸性高锰酸钾溶液检验;
(3)Cu2O与Al在高温下反应生成Cu和Al2O3,为铝热反应;
(4)镁带起到引燃作用,用氯酸钾作助燃剂,生成氧气,有利于镁的燃烧;
(5)计算n(Cu2+),可计算出CuSO4?5H2O的质量,进而计算质量分数;
(6)导致CuSO4?5H2O含量的测定结果偏高,应使滴定液的体积偏大.
解答:解:(1)气体A为SO2,可用碱液吸收,则应用NaOH或氨水,故答案为:cd;
(2)检验溶液中存在Fe3+,可用KSCN,溶液变成红色,Fe2+具有还原性,可用酸性高锰酸钾溶液检验,操作为另取少量溶液,滴加几滴高锰酸钾的酸性溶液,紫色褪去,说明溶液中存在Fe2+,
故答案为:硫氰化钾;另取少量溶液,滴加几滴高锰酸钾的酸性溶液,紫色褪去,说明溶液中存在Fe2+;
(3)Cu2O与Al在高温下反应生成Cu和Al2O3,反应的方程式为3Cu2O+2Al
6Cu+Al2O3,
故答案为:3Cu2O+2Al
6Cu+Al2O3;
(4)镁带起到引燃作用,用氯酸钾作助燃剂,生成氧气,有利于镁的燃烧,为防止坠落的高温液体炸裂蒸发皿,蒸发皿内要垫上沙子,不能用水,不能保护蒸发皿不被炸裂,
故答案为:燃烧放出大量的热,创造高温环境(或引燃剂);氯酸钾;不能;
(5)20.00mLn(Cu2+)=n(H2Y2-)=bc×10-3mol,
则ag试样中n(CuSO4?5H2O)=bc×10-3mol×
=5bc×10-3mol,
m(CuSO4?5H2O)=5bc×10-3mol×250g/mol=1.25bcg,
则CuSO4?5H2O质量分数为
=
,
故答案为:
;
(6)a.滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准液至锥形瓶中,对实验无影响,故a错误;
b.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定,会导致溶液浓度偏小,测定结果偏低,故b错误;
c.滴定前,滴定管尖端有气泡,滴定后气泡消失,会导致体积偏大,测定结果偏大,故c正确.
故答案为:c.
(2)检验溶液中存在Fe3+,可用KSCN,溶液变成红色,Fe2+具有还原性,可用酸性高锰酸钾溶液检验,操作为另取少量溶液,滴加几滴高锰酸钾的酸性溶液,紫色褪去,说明溶液中存在Fe2+,
故答案为:硫氰化钾;另取少量溶液,滴加几滴高锰酸钾的酸性溶液,紫色褪去,说明溶液中存在Fe2+;
(3)Cu2O与Al在高温下反应生成Cu和Al2O3,反应的方程式为3Cu2O+2Al
| ||
故答案为:3Cu2O+2Al
| ||
(4)镁带起到引燃作用,用氯酸钾作助燃剂,生成氧气,有利于镁的燃烧,为防止坠落的高温液体炸裂蒸发皿,蒸发皿内要垫上沙子,不能用水,不能保护蒸发皿不被炸裂,
故答案为:燃烧放出大量的热,创造高温环境(或引燃剂);氯酸钾;不能;
(5)20.00mLn(Cu2+)=n(H2Y2-)=bc×10-3mol,
则ag试样中n(CuSO4?5H2O)=bc×10-3mol×
| 100 |
| 20 |
m(CuSO4?5H2O)=5bc×10-3mol×250g/mol=1.25bcg,
则CuSO4?5H2O质量分数为
| 1.25bc |
| a |
| 5bc |
| 4a |
故答案为:
| 5bc |
| 4a |
(6)a.滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准液至锥形瓶中,对实验无影响,故a错误;
b.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定,会导致溶液浓度偏小,测定结果偏低,故b错误;
c.滴定前,滴定管尖端有气泡,滴定后气泡消失,会导致体积偏大,测定结果偏大,故c正确.
故答案为:c.
点评:本题综合考查制备实验的涉及以及物质的分离提纯知识,侧重于综合考查学生的实验能力和数据分析能力,注意把握实验原理和实验方法,题目难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、工业上冶炼铝常用焦炭还原氧化铝 | B、CO2、N02或SO2都会导致酸雨的形成 | C、光导纤维、聚乙烯、油脂都是高分子化合物 | D、可通过加水吸收后再用半透膜渗析的方法分离PM2.5微粒与可溶性吸附物 |
工业上冶炼冰铜(mCu2O·nFeS)可得到粗铜,再以粗铜为原料制备硫酸铜晶体。

完成下列填空:
(1)气体A中的大气污染物可选用下列试剂中的 (填序号)吸收。
a. 浓H2SO4 b. 浓HNO3 c. NaOH溶液 d. 氨水
(2)用稀H2SO4 浸泡熔渣B,取少量所得溶液,滴加 (填物质名称)溶液后呈红色,说明溶液中存在Fe3+,检验溶液中还存在Fe2+的方法是 (注明试剂、现象)。
|

(3)泡铜冶炼粗铜的化学方程式是 。
(4)装置中镁带的作用是 。泡铜和铝粉混合物表面覆盖少量白色固体a,
a是 (填名称)。沙子能否换成水? (填“能”或“不能”)。
(5)用滴定法测定CuSO4·5H2O的含量。取a g试样配成100 mL溶液,取20.00mL用c mol /L 滴定剂(H2Y2–,滴定剂不与杂质反应)滴定至终点,消耗滴定剂bmL,滴定反应:Cu2+ + H2Y2–=CuY2–+ 2H+。则CuSO4·5H2O质量分数的表达式是 。
(6)下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准液至锥形瓶中
b.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定
c.滴定前,滴定管尖端有气泡,滴定后气泡消失
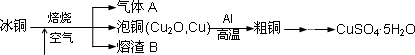
 工业上冶炼冰铜(mCu2O?nFeS)可得到粗铜,再以粗铜为原料制备硫酸铜晶体.
工业上冶炼冰铜(mCu2O?nFeS)可得到粗铜,再以粗铜为原料制备硫酸铜晶体.
 ?CuY2-+2H+.则CuSO4?5H2O质量分数的表达式是______.
?CuY2-+2H+.则CuSO4?5H2O质量分数的表达式是______.