题目内容
【题目】某化学兴趣小组利用还原铁粉处理含Fe(NO3)3、Cu(NO3)2、HNO3的废水,所加还原铁粉的质量与溶液中Fe2+的浓度变化关系如下图(忽略溶液体积变化)。下列有关结论错误的是( )
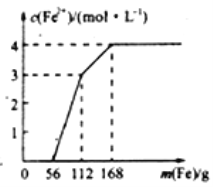
A. 加入铁粉质量小于56g时发生的反应为Fe+NO3-+4H+=Fe3++NO↑+2H2O
B. 当加入的铁粉质量超过168g后,溶液中的溶质只含有Fe(NO3)2(忽略Fe2+的水解)
C. 原废水中Fe(NO3)3的浓度为2mol/L,Cu(NO3)2的浓度均为1mol/L
D. 原废水中三种物质的氧化性由强到弱的顺序是HNO3>Fe(NO3)3>Cu(NO3)2
【答案】C
【解析】
刚开始加入56g(1mol)单质铁,溶液中不生成Fe2+,所以发生的化学反应一定是铁被硝酸氧化为Fe3+。其方程式为:Fe+NO3-+4H+=Fe3++NO↑+2H2O。选项A正确。当加入的单质铁完全过量的时候,溶液中的Fe(NO3)3、Cu(NO3)2、HNO3应该都被反应为Fe(NO3)2,选项B正确。56g至112g(1mol)间加入1molFe,Fe2+的浓度增加3mol/L,而112g至168g(1mol)间加入1molFe,Fe2+的浓度增加1mol/L,所以说明前一个1molFe发生的是Fe + 2Fe3+ =3Fe2+,后一个1mol反应为Fe + Cu2+ =Fe2+ + Cu,将反应物均为1molFe带入计算,得到Fe(NO3)3浓度为2mol/L,Cu(NO3)2的浓度为1mol/L,但是考虑到第一步中加入的1molFe和硝酸反应得到了1mol/L的Fe(NO3)3,所以原废水中Fe(NO3)3浓度为1mol/L,选项C错误。因为废水中三种物质和单质铁反应的顺序是HNO3、Fe(NO3)3、Cu(NO3)2,反应中应该是氧化性强的物质先反应,所以氧化性为:HNO3>Fe(NO3)3>Cu(NO3)2。选项D正确。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:

回答下列问题:
(1)步骤①所得废渣的成分是_____________(写化学式),操作II的名称是________________。
(2)步骤②、③的变化过程表示为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n(水层)+2nHA(有机层)![]() 2RAn(有机层)+nH2SO4(水层)
2RAn(有机层)+nH2SO4(水层)
③中X试剂为_____________(写化学式)。
(3)按要求完成下列方程式
④的离子方程式为_________________________________________。
加氨水调节pH过程中涉及的离子方程式为: _________________、_______________。
(4)25时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
在实际生产中,⑤中加入氨水,调节溶液的最佳pH为________;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<_________mol/L(已知:25时,Ksp[Fe(OH)3]=2.610-39)。
(5)该工艺流程中,可以循环利用的物质有___________和_____________。
