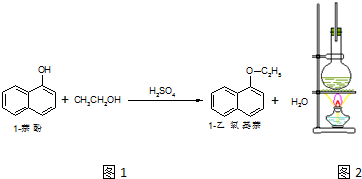
��Ŀ����
10���������NOx������ܶ࣬����N2O��NO��NO2��N2O3��N2O4��N2O5�ȶ��ֻ��������NO��NO2�dz����Ĵ�����Ⱦ�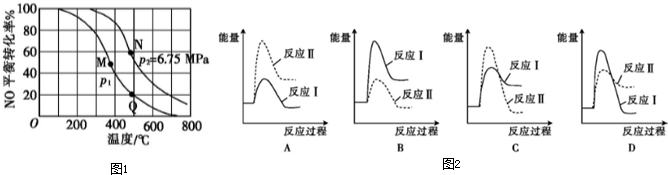
��1�����ܱ������г���2mol NO��1mol O2������Ӧ��2NO��g��+O2��g��?2NO2��g����������������ͬʱ���ֱ���NO��ƽ��ת�����ڲ�ͬѹǿ�����¶ȱ仯��������ͼ1��
�ٸ÷�Ӧ����ӦΪ���ȣ�����ȡ������ȡ�����Ӧ��
��N��Q��������ʴ�С��ϵΪvN����vQ������ڡ���С�ڡ����ڡ�����ͬ����M��N����ʱ���÷�Ӧƽ�ⳣ��KM����KN��
����ʽ����÷�Ӧ��ͼ��N���ƽ�ⳣ��K=2��MPa��-1 ����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������
��2����Ӧ��NO��g��+NO2��g��?N2O3��g����H��0������ij�¶��£���Ӧ������ʣ�v1��С�ڷ�Ӧ������ʣ�v2���������з�Ӧ���������仯ʾ��ͼ��ͼ2����ȷ����D��
���� ��1����ͼ�������֪���¶�����NO��ת���ʼ�С����ƽ��������У��淴ӦΪ���ȷ�Ӧ������ӦΪ���ȷ�Ӧ��
��ͼ�������֪��ͬ�¶��£�һ������ת����N�����Q�㣬˵��N��ѹǿ����Q�㣬��Ӧ���ʴ�ƽ�ⳣ�����¶ȱ仯��NQ���¶���ͬ��ƽ�ⳣ����ͬ��
������ʽ��ʽ����ƽ��ʱ���������ʵ�����ƽ�ⳣ������������ƽ�����ʵķ�ѹ���ݴη��˻����Է�Ӧ��ƽ�����ʵķ�ѹ���ݴη��˻�����õ���
��2����Ӧ��Ϊ���ȷ�Ӧ����Ӧ��Ϊ���ȷ�Ӧ����Ϸ�Ӧ������������������С֮��Ĺ�ϵ�жϣ�
��� �⣺��1����ͼ�������֪�����¶�����NO��ת���ʼ�С�����ݻ�ѧƽ���ƶ�ԭ����֪����ƽ��������У��淴ӦΪ���ȷ�Ӧ������ӦΪ���ȷ�Ӧ��
�ʴ�Ϊ�����ȣ�
��ͼ�������֪��ͬ�¶��£�һ������ת����N�����Q�㣬˵��N��ѹǿ����Q�㣬��Ӧ���ʴ�ƽ�ⳣ�����¶ȱ仯��NQ���¶���ͬ��ƽ�ⳣ����ͬ��MN���¶�N��ߣ�ƽ��������У�����ƽ�ⳣ��С��M��ƽ�ⳣ������N��ƽ�ⳣ����
�ʴ�Ϊ�����ڣ����ڣ�
�����ܱ������г���2mol NO��1mol O2������Ӧ��2NO��g��+O2��g��?2NO2��g����N��NOת����Ϊ60%���������ʵ���Ϊ2mol��60%=1.2mol�����ݻ�ѧƽ������ʽ��ʽ���㣬
2NO��g��+O2��g��?2NO2��g����
��ʼ����mol�� 2 1 0
�仯����mol�� 1.2 0.6 1.2
ƽ������mol�� 0.8 0.4 1.2
���������ʵ���=0.8mol+0.4mol+1.2mol=2.4mol
����ƽ���ѹ����ƽ��Ũ�ȼ����ƽ�ⳣ��K=$\frac{��\frac{1.2}{2.4}p��^{2}}{��\frac{0.8}{2.4}p��^{2}•��\frac{0.4}{2.4}p��}$=$\frac{27}{2p}$=$\frac{27}{2��6.75MPa}$=2��MPa��-1��
�ʴ�Ϊ��2��MPa��-1 ��
��2����Ӧ��Ϊ���ȷ�Ӧ����Ӧ��Ϊ���ȷ�Ӧ����A��C������Ϊ��ͼ�����������������ڷ�Ӧ����������������֪����Ӧ������ʣ�v1�����ڷ�Ӧ������ʣ�v2������Ӧ��Ļ�ܽϴ���B����D��ȷ��
�ʴ�Ϊ��D��
���� ���⿼���˻�ѧƽ��ͼ��ķ����жϣ�ƽ�ⳣ���ĸ�������ͼ��㣬Ӱ�컯ѧƽ��ͻ�ѧ��Ӧ���ʵ����ط���Ӧ�ã����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | ���³�ѹ�£�18.0g NH4+��������������Ϊ10NA | |
| B�� | �����£�8g���麬�й��ۼ���Ϊ2NA | |
| C�� | �����£�2.7g��ƬͶ��������Ũ�����У���ʧȥ�ĵ�����Ϊ0.3NA | |
| D�� | 111g CaCl2�������������õ��ӶԵ���ĿΪ2NA |
| A�� | 201Tl��204Tl��Ϊͬ�������� | |
| B�� | ${\;}_{81}^{201}$Tl��${\;}_{82}^{204}$Pb������ͬ�������� | |
| C�� | Tl������6�����Ӳ� | |
| D�� | Tl��OH��3�������� |
| A�� | �٢� | B�� | �ڢ� | C�� | �ۢ� | D�� | �ޢ� |
 ��ͼ��ҩƷ��˾ƥ�ֵĽṹ��ʽ����ҩƷ�ڢټӳɷ�Ӧ ���û���Ӧ ���кͷ�Ӧ ��������Ӧ�У����ܷ����ķ�Ӧ�У�������
��ͼ��ҩƷ��˾ƥ�ֵĽṹ��ʽ����ҩƷ�ڢټӳɷ�Ӧ ���û���Ӧ ���кͷ�Ӧ ��������Ӧ�У����ܷ����ķ�Ӧ�У�������| A�� | ֻ�٢ڢ� | B�� | ֻ�ۢ� | C�� | ֻ�ڢ� | D�� | �٢ڢۢ� |
| A�� | �����Ħ��������98�� | |
| B�� | �����ӵ³������������ʵ�����1mol | |
| C�� | 1mol 12Cԭ�ӵ�����Ϊ12g | |
| D�� | 6.02��1023mol-1�ǰ����ӵ������Ľ���ֵ |
| A�� | NaOH | B�� | ���� | C�� | ˮ���� | D�� | ����� |