题目内容
某实验小组欲用酸性KMnO4和H2C2O4反应通过测定单位时间内生成 CO2的量来探究影响反应速率的因素,设计实验方案如下:
实验序号 | A 溶液 | B 溶液 |
① | 20 mL 0.1 mol•L-1 H2C2O4 溶液 | 30 mL 0.01 mol•L-1 KMnO4 酸性溶液 |
② | 20 mL 0.2 mol•L-1 H2C2O4 溶液 | 30 mL 0.01 mol•L-1 KMnO4 酸性溶液 |

(1)检验上图装置气密性的最简便方法为:____________。
(2)H2C2O4溶液与酸性 KMnO4溶液反应的化学方程式为____________。
(3)该实验探究的是___________因素对化学反应速率的影响,相同时间内针筒中所得CO2的体积大小关系是___________(填实验序号)。
(4)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO4-)=________(若忽略溶液混合前后体积的变化)。
(5)小组同学发现反应速率总是如上右图所示,积极探究t1~t2时间内速率变快的主要原因,提出假设可能是:①__________、②_________、③K+对该反应有催化作用。
练习册系列答案
相关题目


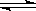 cC(g)+dD(g) ΔH,同时符合下列两图中各曲线的是( )
cC(g)+dD(g) ΔH,同时符合下列两图中各曲线的是( )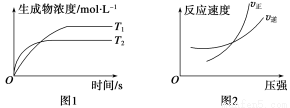
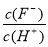 D.
D.
 mZ(g) ΔH,所得Z的平衡浓度如表所示,下列说法正确的是( )
mZ(g) ΔH,所得Z的平衡浓度如表所示,下列说法正确的是( )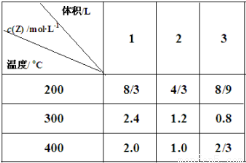
 Ba2++SO42-
Ba2++SO42-