题目内容
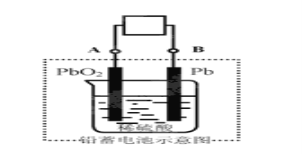
【题目】电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:
Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O,
2PbSO4+2H2O,
则下列说法正确的是:
A.放电时:电子流动方向由A经导线流向B
B.放电时:正极反应是Pb-2e-+SO42-=PbSO4
C.充电时:铅蓄电池的负极应与充电器电的正极相连
D.充电时:阳极反应是PbSO4-2e-+2H2O=PbO2+SO42-+4H+
【答案】D
【解析】
试题分析:由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,放电时,Pb被氧化,应为电池负极反应,电极反应式为Pb-2e-+SO42-=PbSO4,正极上PbO2得电子被还原,电极反应式为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,在充电时,阳极上发生氧化反应,电极反应式和放电时的正极反应互为逆反应,阴极上发生还原反应,电极反应式和放电时的负极反应互为逆反应.A.放电时,Pb极即B极为电池负极,PbO2极即A极为正极,电流方向由正极经导线流向负极,即由A经导线流向B,错误;B.放电时,正极上二氧化铅得电子和硫酸根离子反应生成硫酸铅,电极反应式为:PbO2+2e-+SO42-=PbSO4,错误; C.在充电时,铅蓄电池的负极的逆反应是还原反应,应与充电器电源的负极相连,错误;D.充电时,阳极上电极反应式为PbSO4-2e-+2H2O=PbO2+SO42-+4H+,故D正确;故选D.

练习册系列答案
相关题目