题目内容
下列有关离子方程式书写错误的是:
| A.将标准状况下1.12 L氯气通入10 mL 1 mol / L的溴化亚铁溶液中:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 |
| B.向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:Ca2++ HCO3- +OH-=CaCO3↓+H2O |
| C.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++ SO42- + NH4+=BaSO4↓+ NH3·H2O +H2O |
| D.向NaHSO3溶液中滴入适量NaClO溶液:HSO3–+ ClO–=SO42–+ H+ + Cl– |
B
解析试题分析:A、将标准状况下1.12 L氯气通入10 mL 1 mol / L的溴化亚铁溶液中,氯气过量,离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2,正确;B、向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液,离子方程式应为:Ca2++ 2HCO3- +2OH-=CaCO3↓+2H2O+ CO32-,错误;C、向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++ SO42- + NH4+=BaSO4↓+ NH3·H2O +H2O,正确;D、向NaHSO3溶液中滴入适量NaClO溶液,ClO–具有强氧化性,将HSO3–氧化为硫酸根,本身被还原为氯离子,离子方程式为:HSO3–+ ClO–=SO42–+ H+ + Cl–,正确。
考点:考查离子方程式正误判断。

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
下列各组离子在溶液中能大量共存的是
A.Na+、Al3+、Cl-、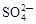 | B.Cu2+、Cl-、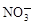 、OH- 、OH- |
C.Ca2+、Na+、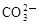 、 、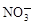 | D.H+、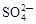 、 、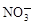 、OH- 、OH- |
下列各组中两种物质在溶液里的反应,可用同一离子方程式表示的是
| A.KCl+AgNO3;AlCl3+ AgNO3 |
| B.NaHCO3+H2SO4;Na2CO3+HCl |
| C.NaHCO3+NaOH;Ca(HCO3)+KOH |
| D.BaCl2+H2SO4;Ba(OH)2+H2SO4 |
能正确表示下列反应的离子方程式为
| A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3― + OH― = CO32―+ H2O |
| B.二氧化硫通入次氯酸钠溶液:SO2 + ClO― + 2OH―= SO42―+Cl―+H2O |
| C.硫化钡加入稀硫酸:BaS + 2H+= H2S↑+ Ba2+ |
| D.硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ |
某无色溶液中可能含有①Na+、②Ba2+、③Cl-、④Br-、⑤SO32-、⑥SO42-离子中的若干种,依顺序进行下列实验,且每步所加试剂均过量,观察到的现象如下:
| 步骤 | 操作 | 现象 |
| 1 | 用pH试纸检验 | 溶液的pH大于7 |
| 2 | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
| 3 | 分液,向上层溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| 4 | 过滤,向滤液中加入AgNO3溶液 | 有白色沉淀产生 |
A.肯定含有的离子是①④⑤
B.肯定没有的离子是②⑥
C.不能确定的离子是①
D.不能确定的离子是③⑤
在含有Fe2+、Fe3+、Al3+、NH4+的溶液中加入足量的Na2O2固体,再加入过量的稀HCl,完全反应后,离子数目几乎没有改变的是( )
| A.Fe2+ | B.Al3+ | C.Fe3+ | D.NH4+ |
下列各组离子在指定的溶液中不能大量共存的是
| A.滴入KSCN溶液显红色的溶液中:K+、Fe2+、SO42–、Cl– |
| B.1 mol·L–1的烧碱溶液中:S2–、SO32–、S2–、K+ |
| C.使淀粉碘化钾试纸变蓝的溶液中:Cs+、Ba2+、S2–、Cl– |
| D.含有大量HCO3–的澄清透明溶液中:K+、NH4+、Cl–、Na+ |
下列离子方程式正确的是
| A.氨水吸收足量的SO2气体:OH-+SO2=HSO3- |
| B.将铜丝投入稀硝酸中:Cu+4H++NO3-=Cu2++NO2↑+2H2O |
| C.将H2O2滴入酸性KMnO4溶液中:2MnO4-+10H++3H2O2=2Mn2++3O2↑+8H2O |
| D.NaHSO4溶液中加入过量Ba(OH)2溶液:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
下列各组离子在指定溶液中,能大量共存的是
| A.含有NaClO的溶液中:K+、NH4+、 Fe3+、Br-、S2- |
| B.在c(HCO3-)=0.1 mol·L-1的溶液中:NH4+、Al3+、Cl-、NO3- |
| C.加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42- |
| D.使pH试纸变红的溶液中:Fe2+、MnO4-、Na+、SO42- |