题目内容
【题目】【化学—选修3物质结构与性质】
氮、磷、砷的单质及其化合物在生产生活中有重要的作用。回答下列问题:
(1)N元素原子核外电子排布图为____________,基态As原子有________种不同能量的电子。
(2)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子中N原子的杂化方式为__________,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是 。
(3)N、P、As氢化物沸点由高到低的顺序是 ,原因是 。
(4)根据结构与性质的关系,说明H3AsO4的酸性比H3AsO3强的原因: 。
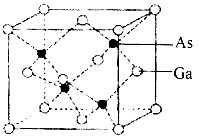
(5)砷化镓属于第三代半导体,晶胞结构如图。晶胞中距离Ga原子等距最近的Ga原子有 个,Ga与周围等距最近的As形成的空间构型为____________。已知砷化镓晶胞边长为a pm,NA表示阿伏加德罗常数的数值,其密度为 gcm-3(列出计算式即可)。
【答案】除标注外,其余每空均2分
(1)![]() (1分) ;8(1分)
(1分) ;8(1分)
(2)sp2杂化(1分);O>N> Co >K
(3)NH3>AsH3>PH3;NH3分子间能形成氢键,沸点最高,AsH3与PH3都为分子晶体,但AsH3相对分子质量更大,分子间作用力更大,沸点更高。
(4)H3AsO4的非羟基氧个数比H3AsO3的多,所以酸性更强。
(5)12(1分);正四面体(1分);
【解析】
试题分析:
(1)N元素原子核外电子排布图为![]() ,基态As原子有1s、2s、2p、3s、3p、3d、4s、4p八个能级,即八种不同能量的电子。
,基态As原子有1s、2s、2p、3s、3p、3d、4s、4p八个能级,即八种不同能量的电子。
(2)NO2-离子中N原子的价层电子对数为3对,故采取sp2杂化;电负性与非金属性一致,所以K3[Co(NO2)6] 中四种元素的电负性由大到小的顺序是O>N> Co >K。
(3)N、P、As氢化物沸点由高到低的顺序是NH3>AsH3>PH3,原因是NH3分子间能形成氢键,沸点最高,AsH3与PH3都为分子晶体,但AsH3相对分子质量更大,分子间作用力更大,沸点更高。
(4)H3AsO4的酸性比H3AsO3强,是因为H3AsO4的非羟基氧个数比H3AsO3的多,所以酸性更强。
(5)晶胞中距离Ga原子等距最近的Ga原子有12个,Ga与周围等距最近的As形成的空间构型为正四面体。密度=晶胞的质量÷晶胞的体积= 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】工业上用某矿渣(含有Cu2O(主要)、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:

已知:Cu2O+2H+=Cu+Cu2++H2O
沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
(1)固体混合物A中的成分是______________.
(2)反应Ⅰ完成后,铁元素的存在形式为_____________.(填离子符号)请写出生成该离子的离子方程式_________________________.
(3)沉淀B可用于制造铁红,为了保证铁红的质量则x的取值为_____________。
(4)书写出由沉淀C制备铝的化学方程式:___________________。
