题目内容
下列溶液中溶质的物质的量浓度为1mol/L的是
- A.将40gNaOH溶解在1L水中
- B.将1L10mol/L的浓盐酸加入9L水中
- C.将22.4LHCl气体溶于水配成1L溶液
- D.将10gNaOH溶解在少量水中,再加蒸馏水直到溶液体积为250mL
D
分析:A、40gNaOH的物质的量为1mol,溶于水配成1L溶液,所得溶液浓度为1mol/L;
B、溶液体积不具有加合性;
C、压强,氯化氢所处的状态不一定是标准状况,体积一定,影响气体的物质的量的因素有温度;
D、根据m= 计算氢氧化钠的物质的量,再根据c=
计算氢氧化钠的物质的量,再根据c= 计算溶液的物质的量浓度.
计算溶液的物质的量浓度.
解答:A、40gNaOH的物质的量为1mol,溶于水配成1L溶液,所得溶液浓度为1mol/L,体积1L是指溶液的体积,不是溶剂的体积,故A错误;
B、溶液体积不具有加合性,混合后溶液的体积不是10L,故B错误;
C、氯化氢所处的状态不一定是标准状况,不能使用气体摩尔体积22.4L/mol,体积一定,影响气体的物质的量的因素有温度、压强,22.4LHCl气体的物质的量不一定是1mol,故C错误;
D、10gNaOH的物质的量为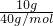 =0.25mol,溶解在少量水中,再加蒸馏水直到溶液体积为250mL,所得溶液的物质的量浓度为
=0.25mol,溶解在少量水中,再加蒸馏水直到溶液体积为250mL,所得溶液的物质的量浓度为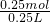 =1mol/L,故D正确.
=1mol/L,故D正确.
故选D.
点评:本题考查学生对物质的量浓度的理解与计算,比较基础,注意C中气体摩尔体积的使用对象与条件.
分析:A、40gNaOH的物质的量为1mol,溶于水配成1L溶液,所得溶液浓度为1mol/L;
B、溶液体积不具有加合性;
C、压强,氯化氢所处的状态不一定是标准状况,体积一定,影响气体的物质的量的因素有温度;
D、根据m=
 计算氢氧化钠的物质的量,再根据c=
计算氢氧化钠的物质的量,再根据c= 计算溶液的物质的量浓度.
计算溶液的物质的量浓度.解答:A、40gNaOH的物质的量为1mol,溶于水配成1L溶液,所得溶液浓度为1mol/L,体积1L是指溶液的体积,不是溶剂的体积,故A错误;
B、溶液体积不具有加合性,混合后溶液的体积不是10L,故B错误;
C、氯化氢所处的状态不一定是标准状况,不能使用气体摩尔体积22.4L/mol,体积一定,影响气体的物质的量的因素有温度、压强,22.4LHCl气体的物质的量不一定是1mol,故C错误;
D、10gNaOH的物质的量为
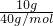 =0.25mol,溶解在少量水中,再加蒸馏水直到溶液体积为250mL,所得溶液的物质的量浓度为
=0.25mol,溶解在少量水中,再加蒸馏水直到溶液体积为250mL,所得溶液的物质的量浓度为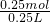 =1mol/L,故D正确.
=1mol/L,故D正确.故选D.
点评:本题考查学生对物质的量浓度的理解与计算,比较基础,注意C中气体摩尔体积的使用对象与条件.

练习册系列答案
相关题目