题目内容
抢救地震后被困在废墟下的伤员,首要的措施是给伤员补充能量.右图是医院病人输液时用的一瓶葡萄糖(C6H12O6)注射液(质量分数为5%)的标签,请认真观察标签上所列内容后填写:(1)葡萄糖的摩尔质量为 .
(2)该溶液中含水 g.该溶液的密度约为 g?mL-1.
(3)该溶液的物质的量浓度为 mol?L-1(精确到小数点后面两位).
(4)血液中甘油三酯(假设其化学式为C55H104O6,M=860)的含量是人体健康重要参数.正常人的甘油三酯的含量为0.8~2.2mmol/L.在某次体检中,测得某被检者血液的密度为0.99g?mL-1,血液中甘油三酯的质量分数为1.72‰,则该被检者甘油三酯的含量 (填“偏低”、“正常”、“偏高”或“无法确定”).

【答案】分析:(1)葡萄糖的摩尔质量在数值上等于它的相对分子质量,单位是g/mol;
(2)根据标签给出的数据可知,250ml葡萄糖注射液中含葡萄糖12.5g,含量为5%,根据“葡萄糖质量÷葡萄糖含量”计算出一瓶葡萄糖注射液的质量;根据溶液中含水的质量=葡萄糖注射液的质量×水的含量(1-葡萄糖质量分数);根据溶液的密度=一瓶葡萄糖注射液的质量÷体积;
(3)先根据葡萄糖的质量求出它的物质的量,然后代入公式C=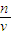 求出溶液的物质的量浓度;
求出溶液的物质的量浓度;
(4)根据血液的密度、血液中甘油三酯的质量分数求出甘油三酯的物质的量浓度,与正常的参数比较判断含量的高低.
解答:解:(1)葡萄糖的相对分子质量为:12×6+12+16×6=180,所以葡萄糖的摩尔质量为:180g/mol,故答案为:180g/mol;
(2)由于溶液中溶质的质量分数为5%,且含有共12.5g葡萄糖,一瓶葡萄糖注射液溶液的质量=12.5g÷5%=250g,所以该溶液中含水的质量=250g×(1-5%)=237.5g;溶液的密度=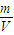 =
=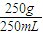 =1g/mL,即1g/cm3.
=1g/mL,即1g/cm3.
故答案为:237.5;1.
(3)葡萄糖物质的量为n(C6H12O6)=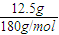 ,
,
所以溶液的物质的量浓度C(C6H12O6)=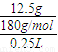 =0.28mol?L-1,
=0.28mol?L-1,
故答案为:0.28;
(4)设测得某被检者血液的体积为1L,则溶液的质量为:0.99g?mL-1×1000mL=990g,血液中甘油三酯的质量为990g×1.72‰,物质的量为: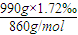 ,
,
所以血液中甘油三酯的物质的量浓度为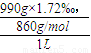 =0.00198mol/L=1.98mmol/L,所以说被检者甘油三酯的含量正常,故答案为:正常.
=0.00198mol/L=1.98mmol/L,所以说被检者甘油三酯的含量正常,故答案为:正常.
点评:解题时要注意摩尔质量在数值上等于该物质的相对分子质量,但是它是有单位的,单位是g/mol;根据标签给出的数据进行计算,其中用到了物质的质量分数公式和质量、密度与体积的关系,知道ρ=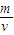 和C=
和C=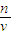 这两个公式中体积的单位不同.
这两个公式中体积的单位不同.
(2)根据标签给出的数据可知,250ml葡萄糖注射液中含葡萄糖12.5g,含量为5%,根据“葡萄糖质量÷葡萄糖含量”计算出一瓶葡萄糖注射液的质量;根据溶液中含水的质量=葡萄糖注射液的质量×水的含量(1-葡萄糖质量分数);根据溶液的密度=一瓶葡萄糖注射液的质量÷体积;
(3)先根据葡萄糖的质量求出它的物质的量,然后代入公式C=
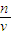 求出溶液的物质的量浓度;
求出溶液的物质的量浓度;(4)根据血液的密度、血液中甘油三酯的质量分数求出甘油三酯的物质的量浓度,与正常的参数比较判断含量的高低.
解答:解:(1)葡萄糖的相对分子质量为:12×6+12+16×6=180,所以葡萄糖的摩尔质量为:180g/mol,故答案为:180g/mol;
(2)由于溶液中溶质的质量分数为5%,且含有共12.5g葡萄糖,一瓶葡萄糖注射液溶液的质量=12.5g÷5%=250g,所以该溶液中含水的质量=250g×(1-5%)=237.5g;溶液的密度=
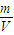 =
=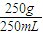 =1g/mL,即1g/cm3.
=1g/mL,即1g/cm3.故答案为:237.5;1.
(3)葡萄糖物质的量为n(C6H12O6)=
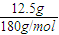 ,
,所以溶液的物质的量浓度C(C6H12O6)=
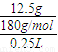 =0.28mol?L-1,
=0.28mol?L-1,故答案为:0.28;
(4)设测得某被检者血液的体积为1L,则溶液的质量为:0.99g?mL-1×1000mL=990g,血液中甘油三酯的质量为990g×1.72‰,物质的量为:
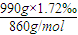 ,
,所以血液中甘油三酯的物质的量浓度为
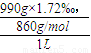 =0.00198mol/L=1.98mmol/L,所以说被检者甘油三酯的含量正常,故答案为:正常.
=0.00198mol/L=1.98mmol/L,所以说被检者甘油三酯的含量正常,故答案为:正常.点评:解题时要注意摩尔质量在数值上等于该物质的相对分子质量,但是它是有单位的,单位是g/mol;根据标签给出的数据进行计算,其中用到了物质的质量分数公式和质量、密度与体积的关系,知道ρ=
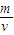 和C=
和C=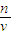 这两个公式中体积的单位不同.
这两个公式中体积的单位不同. 
练习册系列答案
相关题目



