题目内容
25 ℃、101 kPa时,A.CH4O(l)+![]() O2(g)
O2(g)![]() CO2(g)+2H2O(l) ΔH=-725.8 kJ·mol-1
CO2(g)+2H2O(l) ΔH=-725.8 kJ·mol-1
B.2CH4O(l)+3O2(g)![]() 2CO2(g)+4H2O(l) ΔH=+1 451.6 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=+1 451.6 kJ·mol-1
C.2CH4O+3O2(g)![]() 2CO2(g)+4H2O(l) ΔH=-22.68 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-22.68 kJ·mol-1
D.CH4O(l)+![]() O2(g)
O2(g)![]() CO2(g)+2H2O(g)ΔH=-725.8 kJ·mol-1
CO2(g)+2H2O(g)ΔH=-725.8 kJ·mol-1
解析:1 mol CH4O完全燃烧放出热量为22.68 kJ·g-1×
答案:A

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
 (aq)+
(aq)+ (aq)+2
(aq)+2 (aq) = BaSO4(s)+2H
(aq) = BaSO4(s)+2H O(l);
O(l);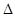 H =
H = 57.3 kJ/mol
57.3 kJ/mol H
H O
O 57.3 kJ/mol
57.3 kJ/mol H2 SO4(aq)=
H2 SO4(aq)= O2(g)=8CO2(g)+9H2O △H=
O2(g)=8CO2(g)+9H2O △H= (aq)+
(aq)+ (aq)+2OH
(aq)+2OH (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H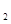 O(1);
O(1); H=
H= 57.3
kJ/mol
57.3
kJ/mol B.KOH(aq)+
B.KOH(aq)+ H
H O(I);
O(I);  O
O