题目内容
120°C时,在密闭容器中点燃20.8g甲烷和氧气的混合气,甲烷完全反应后将混合气体依次通过足量的浓硫酸和足量的澄清石灰水,前者增重10.8g(设整个过程中,外界条件保持不变).试通过计算回答:
(1)写出该条件下甲烷和氧气反应的化学方程式.
(2)此时在石灰水中生成沉淀的质量是多少?
(1)写出该条件下甲烷和氧气反应的化学方程式.
(2)此时在石灰水中生成沉淀的质量是多少?
分析:(1)根据水的质量可计算甲烷的质量,根据总质量可知氧气的质量,进而判断生成物并书写相关反应的化学方程式;
(2)根据方程式计算生成沉淀的质量.
(2)根据方程式计算生成沉淀的质量.
解答:解:(1)n(H2O)=
=0.6mol,
则:n(CH4)=
×n(H2O)=
×0.6mol=0.3mol
m(CH4)=0.3mol×16g/mol=4.8g,
m(O2)=20.8g-4.8g=16g,
n(O2)=
=0.5mol,
n(CH4):n(O2)=0.3mol:0.5mol=3:5,
则反应的方程式为:3CH4+5O2
CO2+2CO+6H2O,
答:该条件下甲烷和氧气反应的化学方程式为3CH4+5O2
CO2+2CO+6H2O.
(2)由反应方程式3CH4+5O2
CO2+2CO+6H2O可知,n(CO2)=
×n(CH4)=
×0.3mol=0.1mol,
则:n(CaCO3)=n(CO2)=0.1mol,
m(CaCO3)=0.1mol×100g/mol=10.0g,
答:在石灰水中生成沉淀的质量是10.0g.
| 10.8g |
| 18g/mol |
则:n(CH4)=
| 1 |
| 2 |
| 1 |
| 2 |
m(CH4)=0.3mol×16g/mol=4.8g,
m(O2)=20.8g-4.8g=16g,
n(O2)=
| 16g |
| 32g/mol |
n(CH4):n(O2)=0.3mol:0.5mol=3:5,
则反应的方程式为:3CH4+5O2
| 点燃 |
答:该条件下甲烷和氧气反应的化学方程式为3CH4+5O2
| 点燃 |
(2)由反应方程式3CH4+5O2
| 点燃 |
| 1 |
| 3 |
| 1 |
| 3 |
则:n(CaCO3)=n(CO2)=0.1mol,
m(CaCO3)=0.1mol×100g/mol=10.0g,
答:在石灰水中生成沉淀的质量是10.0g.
点评:本题考查化学方程式的计算,题目难度不大,注意判断反应的方程式为解答本题的关键.

练习册系列答案
相关题目
20.在常压和120℃时,在密闭容器中充入H2S和O2的混合气体共100 mL,用电火花点燃,经充分反应后,恢复到原状况,测定容器内残留气体的体积。经测定,残留气体的体积V1随原混合气体中O2的体积V2(O2)增加而变化,其关系如右图所示。
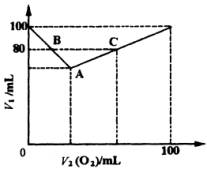
(1)把A、B、C各点的有关数据填入下表:
|
|
A |
B |
C |
|
反应前混合气体各成分体积 |
|
|
|
|
反应后残留气体各成分体积 |
|
|
|
(2)讨论V1和V2(O2)的关系,并用含V1和V2(O2)的函数式表示之。
(3)若残留气体体积V1=90mL,原混合气体的成分是________或________。
20.在常压和120℃时,在密闭容器中充入H2S和O2的混合气体共100 mL,用电火花点燃,经充分反应后,恢复到原状况,测定容器内残留气体的体积。经测定,残留气体的体积V1随原混合气体中O2的体积V2(O2)增加而变化,其关系如右图所示。


(1)把A、B、C各点的有关数据填入下表:
|
|
A |
B |
C |
|
反应前混合气体各成分体积 |
|
|
|
|
反应后残留气体各成分体积 |
|
|
|
(2)讨论V1和V2(O2)的关系,并用含V1和V2(O2)的函数式表示之。
(3)若残留气体体积V1=90mL,原混合气体的成分是________或________。