题目内容
【题目】(1)烷烃C5H12的一种同分异构体只能生成一种一氯代物,该异构体的结构简式为______。
(2)2,2,3,3-四甲基戊烷的结构简式为:___________。
(3)![]() 的系统命名:________。
的系统命名:________。
(4)1mol不饱和烃可以和1molCl2发生加成反应,生成2-甲基-2,3-二氯戊烷,则该不饱和烃的结构简式是:______。
(5)相对分子量相近的醇和烷烃相比,醇的沸点远远高于烷烃,原因是__________。
(6)相同质量的甲烷,乙烷,乙烯和乙炔,完全燃烧后生成CO2最多的是_________。
【答案】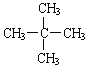 C(CH3)3C(CH3)2CH2CH3 2-甲基-1-丁烯 (CH3)2C=CH-CH2CH3 醇分子之间形成了氢键 乙炔
C(CH3)3C(CH3)2CH2CH3 2-甲基-1-丁烯 (CH3)2C=CH-CH2CH3 醇分子之间形成了氢键 乙炔
【解析】
(1)烷烃C5H12的一种同分异构体只能生成一种一氯代物,则该物质只含有一种位置的H原子,据此书写结构简式;
(2)烷烃主链上有五个C原子,在主链的2、3号C原子上分别有2个甲基,然后根据烷烃的C原子价电子为4,用H原子补齐,即得该物质的结构简式;
(3)从左端给主链上C原子编号,以确定碳碳双键和甲基在主链上的位置,然后对其命名;
(4)将2-甲基-2,3-二氯戊烷的2个Cl原子去掉,将碳碳单键改为碳碳双键,就是该物质的结构简式;
(5)醇的分子之间有氢键,增加了分子之间的吸引力,使物质的熔沸点增大;
(6)等质量的物质,C元素的含量越多,反应产生的CO2也越多。
(1)烷烃C5H12的一种同分异构体只能生成一种一氯代物,则该物质只含有一种位置的H原子,该物质的结构简式为 ;
;
(2) 2,2,3,3-四甲基戊烷的结构简式为C(CH3)3C(CH3)2CH2CH3;
(3)从左端给主链上C原子编号,以确定碳碳双键和甲基在主链上的位置,然后用系统命名方法对其命名为2-甲基-1-丁烯;
(4)将2-甲基-2,3-二氯戊烷的2个Cl原子去掉,将碳碳单键改为碳碳双键,就是该物质的结构简式为(CH3)2C=CH-CH2CH3;
(5)相对分子量相近的醇和烷烃相比,由于醇分子之间有氢键,增加了醇分子之间的吸引力,从而使醇的沸点远远高于相应烷烃;
(6)相同质量的甲烷,乙烷,乙烯和乙炔中,C元素的含量最高的是乙炔,碳元素的含量越多,等质量的物质中C元素的质量就越多,则其完全燃烧后生成CO2也最多。因此相同质量的甲烷,乙烷,乙烯和乙炔,完全燃烧后生成CO2最多的是乙炔。

 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】硼(B)可形成H3BO3、NaBH4、NaBO2等化合物,用途广泛。
(1)H3BO3为一元弱酸,常温下,在水中存在如下电离平衡:
H3BO3 + H2O![]() [B(OH)4]-+H+,Ka=5.72×10-10。
[B(OH)4]-+H+,Ka=5.72×10-10。
① 25℃时,0.175 mol/L的H3BO3溶液pH约为_________(取整数)。
② 已知碳酸H2CO3的电离平衡常数为Ka1 = 4.4×10-7,Ka2 = 5.6×10-11。将少量碳酸钠溶液滴加到饱和硼酸溶液中,反应的离子方程式为_________。
(2)在容积恒定为2 L的密闭容器中加入足量BPO4和Na固体并充入一定量的H2(g)发生储氢反应:BPO4(s)+4Na(s)+2H2(g)![]() Na3PO4(s)+NaBH4(s) △H<0
Na3PO4(s)+NaBH4(s) △H<0
① 体系中H2的物质的量与反应时间的关系如表所示:
t /min | 0 | 2 | 4 | 6 | 8 | 10 |
n(H2)/mol | 2.0 | 1.5 | 1.2 | 0.9 | 0.8 | 0.8 |
下列有关叙述正确的是(填标号)_________。
a. 当容器内气体的摩尔质量不再变化时,反应达到平衡状态
b. 10 min时向容器内通入少量H2,则重新达平衡前ν(放氢)> ν(吸氢)
c. 保持温度不变,平衡后再充入1 mol H2,达新平衡时H2的浓度为0.4 mol/L
d. 升高温度,放氢速率加快,重新达到平衡时容器压强增大
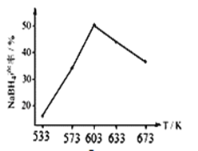
② 下图为相同时间,NaBH4的产率与反应温度的关系曲线。NaBH4的产率在603K之前随温度升高而增大的原因是_________。
(3)NaBH4(s)遇H2O(l)剧烈水解,生成氢气和NaBO2(s)。
① 通常状况下,实验测得3.8gNaBH4(s)发生水解反应放出21.6 kJ热量,写出该反应的热化学方程式_________。
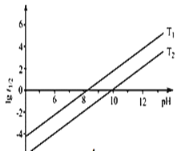
② t1/2为NaBH4水解的半衰期(水解一半所需要的时间,单位为min)。lg t1/2随pH和温度的变化如图所示。溶液pH=4时,NaBH4________(填“能”或“不能”)稳定存在;T1_________T2。(填 “>”或“<”)
【题目】下表是A、B、C、D四种有机物的有关信息:
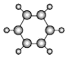
A | ①能使溴的四氯化碳溶液褪色;②比例模型为: |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为100的酯 |
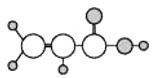
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的官能团名称为________。写出A在一定条件下反应生成高分子化合物的方程式:___________________。
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=___________________时,这类有机物开始出现同分异构体。
(3)关于B的说法正确的是:___________________。
a、所有原子在同一个平面上 b、六个碳原子之间是单双建交替的结构
c、一个B分子含有6个σ键 d、含有苯环的化合物成为芳香化合物
(4)C与D反应能生成相对分子质量为100的酯,该反应的反应类型为___________________;其化学方程式为___________________。