题目内容
【题目】下图为元素周期表的一部分,请参照①~⑨在表中的位置,回答下列问题:
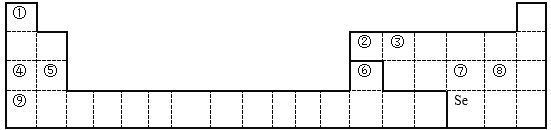
(1)②的元素符号是__________,⑥在周期表中的位置是___________。
(2)⑦、⑧两元素比较,非金属性强的是(填元素符号)_______,从原子结构角度解释原因_________。
(3)④-⑥这三种元素中,写出最高价氧化物对应水化物两两之间能反应的离子方程式____________________。
(4)写出工业冶炼元素⑤单质的化学方程式_________,不选择热还原法冶炼这种活泼金属的原因是___________________。
(5)元素①和③可以组成很多种物质,写出其中原子个数比为1:4的物质的电子式______,请从化学键角度解释该物质中原子个数比为1:4的原因________________。
(6)已知Se在周期表中的位置如图所示,请画出Se的原子结构示意图________。
请任意写出三种Se物质的化学式,预测其性质(一条即可),并说明预测依据,完成在下列表格中。________
含Se物质化学式 | 性质 | 预测依据 |
【答案】 B 第3周期第IIIA族 Cl 硫、氯位于同一周期,电子层数相同,氯原子的核电荷数大于硫原子,吸引电子能力更强,原子半径更小,得电子能力更强,非金属性更强 Al(OH)3+OH-=AlO2-+2H2O MgCl2![]() Mg+Cl2 ↑ 镁是一种比较活泼的金属,想找到比它更活泼的金属如钠还原得到它,但是更活泼的金属如Na会先与水反应,即使选用熔融状态也得注意隔绝氧气,条件比较苛刻,不易实现
Mg+Cl2 ↑ 镁是一种比较活泼的金属,想找到比它更活泼的金属如钠还原得到它,但是更活泼的金属如Na会先与水反应,即使选用熔融状态也得注意隔绝氧气,条件比较苛刻,不易实现 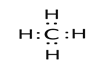 碳原子最外层电子数为4,需要得到4个电子达到8稳定结构,同时,氢原子最外层电子数为1,需要得到1个电子达到2电子稳定结构,因此,二者通过形成4个共用电可使二者都达到稳定结构
碳原子最外层电子数为4,需要得到4个电子达到8稳定结构,同时,氢原子最外层电子数为1,需要得到1个电子达到2电子稳定结构,因此,二者通过形成4个共用电可使二者都达到稳定结构 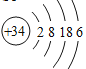 答案合理给分
答案合理给分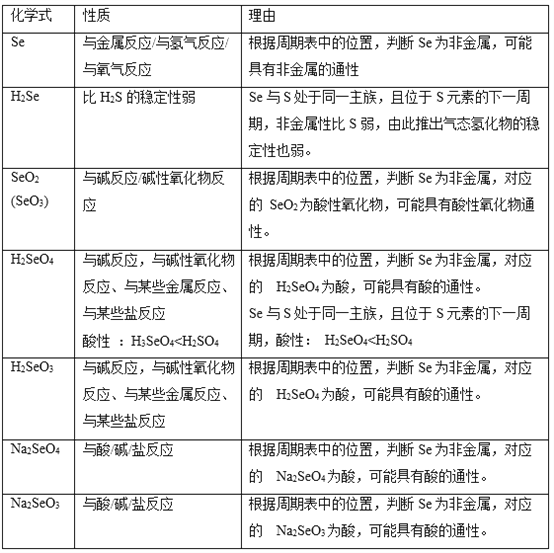
【解析】由元素在周期表中的位置可知,①为H,②为B,③为C,④为Na,⑤为Mg,⑥为Al,⑦为S,⑧为Cl,⑨为K,
(1)②的元素符号是B,⑥在周期表中的位置是第3周期第IIIA族。
(2)⑦S、⑧Cl两元素比较,非金属性强的是(填元素符号)Cl,从原子结构角度解释原因硫、氯位于同一周期,电子层数相同,氯原子的核电荷数大于硫原子,吸引电子能力更强,原子半径更小,得电子能力更强,非金属性更强。
(3)④-⑥这三种元素中,最高价氧化物对应水化物NaOH、Mg(OH)2 、Al(OH)3 两两之间能反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O 。
(4)工业冶炼元素⑤Mg单质,用电解MgCl2化学方程式MgCl2![]() Mg+Cl2 ↑,不选择热还原法冶炼这种活泼金属的原因是镁是一种比较活泼的金属,想找到比它更活泼的金属如钠还原得到它,但是更活泼的金属如Na会先与水反应,即使选用熔融状态也得注意隔绝氧气,条件比较苛刻,不易实现。
Mg+Cl2 ↑,不选择热还原法冶炼这种活泼金属的原因是镁是一种比较活泼的金属,想找到比它更活泼的金属如钠还原得到它,但是更活泼的金属如Na会先与水反应,即使选用熔融状态也得注意隔绝氧气,条件比较苛刻,不易实现。
(5)元素①H和③C可以组成很多种物质如:烃,其中原子个数比为1:4的物质CH4的电子式 ,从化学键角度解释该物质中原子个数比为1:4的原因碳原子最外层电子数为4,需要得到4个电子达到8稳定结构,同时,氢原子最外层电子数为1,需要得到1个电子达到2电子稳定结构,因此,二者通过形成4个共用电可使二者都达到稳定结构 。
,从化学键角度解释该物质中原子个数比为1:4的原因碳原子最外层电子数为4,需要得到4个电子达到8稳定结构,同时,氢原子最外层电子数为1,需要得到1个电子达到2电子稳定结构,因此,二者通过形成4个共用电可使二者都达到稳定结构 。
(6)Se的原子结构示意图 。三种Se物质的化学式,预测其性质:
。三种Se物质的化学式,预测其性质: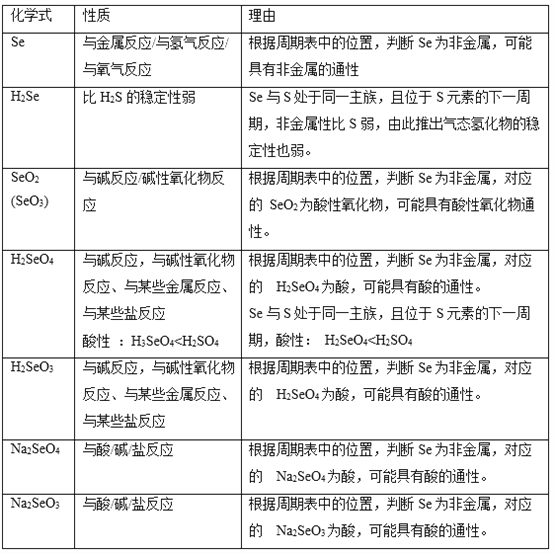

【题目】Ca3N2某实验小组利用如下装置(部分固定装置略)进行氮气与钙的反应,并探究其产物的性质及化学式。请回答下列问题。

(1)仪器B的名称是_____________,B中固体物质为_______________。
(2)反应过程中末端导管必须插入试管C的水中,目的是______。(填字母)
A.吸收反应中剩余的氮气
B.控制通入气体的流速
C.防止空气中的氧气倒流进入反应装置,干扰反应
(3)将制备氮化钙的操作步骤补充完整:
①打开活塞K并通入N2;
②点燃酒精灯,进行反应;
③反应结束后,__________________。
(4)该小组同学认为根据相应的质量关系可以求出生成物的化学式,数据记录如下:
A的质量m0/g | A与钙的质量m1/g | A与产物的质量m2/g |
14.80 | 15.08 | 15.15 |
①通过计算得到化学式CaxN2,其中x=______。
②小组同学查阅资料得知产物为Ca3N2,能与水强烈反应,请写出Ca3N2与水反应的化学方程式_________________,设计实验检验Ca3N2与水反应产物的操作及现象__________________。