题目内容
(21分)
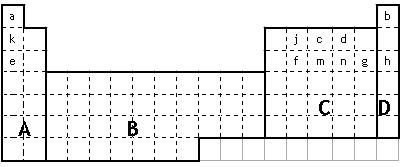
(1)在上面元素周期表中全部是金属元素的区域为 。


(a)A (b)B (c)C (d)D
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或浓硝酸中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是 (填名称),可以验证该结论的实
验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
③写出甲的氧化物及氧化物对应水化物分别与强碱反应的离子方程式
、 。


(3)表中所列小写字母分别代表一种化学元素:
①m、f、j的单质熔点由高到低的顺序___________________________(填元素符号)。
②以上元素形成的金属单质中,熔点最低的是____________________(填元素符号)。
③f、m、n、g所形成的氢化物的稳定性还性由强到弱的顺序为
____________________________________________________________(填化学式);
④甲、乙、c、d、e形成的简单离子的半径由小到大的顺序为
___________________________________________________________。
⑤f元素单质是在生产中用量很大,试写出工业上制备f元素单质的化学方程式
_____________________________________________________________________。
⑥c元素的单质用途_______________________________________________(填一条)。

(1)在上面元素周期表中全部是金属元素的区域为 。



(a)A (b)B (c)C (d)D
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或浓硝酸中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是 (填名称),可以验证该结论的实
验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
③写出甲的氧化物及氧化物对应水化物分别与强碱反应的离子方程式
、 。



(3)表中所列小写字母分别代表一种化学元素:
①m、f、j的单质熔点由高到低的顺序___________________________(填元素符号)。
②以上元素形成的金属单质中,熔点最低的是____________________(填元素符号)。
③f、m、n、g所形成的氢化物的稳定性还性由强到弱的顺序为
____________________________________________________________(填化学式);
④甲、乙、c、d、e形成的简单离子的半径由小到大的顺序为
___________________________________________________________。
⑤f元素单质是在生产中用量很大,试写出工业上制备f元素单质的化学方程式
_____________________________________________________________________。
⑥c元素的单质用途_______________________________________________(填一条)。
(1)b (1分) 

 w
w
(2)①略 (1分) ②Mg (1分) bc. (1分)
③ Al2O3 + 2OH- ="=" 2AlO2- + H2O (2分)
Al(OH)3 + OH- ="=" AlO2-+ 2H2O (2分)
(3)①C Si P (1分) ②Na (1分)
③ HCl 、H2S 、PH3、SiH4(1分)
(4)Al3+、 Mg2+、 Na+、O2-、N3-(1分)
(5) SiO2 + 2C ="=" 2CO + Si (2分)
(6)氮气是合成氨、制硝酸的重要原料;由于其性质稳定常被用作保护气;在高科技领域中常用液氮制造低温环境。(1分)


 w
w(2)①略 (1分) ②Mg (1分) bc. (1分)
③ Al2O3 + 2OH- ="=" 2AlO2- + H2O (2分)
Al(OH)3 + OH- ="=" AlO2-+ 2H2O (2分)
(3)①C Si P (1分) ②Na (1分)
③ HCl 、H2S 、PH3、SiH4(1分)
(4)Al3+、 Mg2+、 Na+、O2-、N3-(1分)
(5) SiO2 + 2C ="=" 2CO + Si (2分)
(6)氮气是合成氨、制硝酸的重要原料;由于其性质稳定常被用作保护气;在高科技领域中常用液氮制造低温环境。(1分)
略

练习册系列答案
相关题目
