题目内容
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、等物质的量的CH4和CO所含分子数均为NA |
| B、电解Na2SO4饱和溶液,若生成2NA个H2,一定生成NA个O2 |
| C、常温下,34.5g NO2与N2O4的混合物中含有1.5NA个氧原子 |
| D、在KClO3+6HCl═KCl+3Cl2↑+3H2O中,每生成3mol Cl2转移电子数为6NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.没有告诉甲烷和一氧化碳的物质的量,无法计算其含有的分子数;
B.电解硫酸钠溶液时,如果电极不是惰性电极,则阳极放电的不是氢氧根离子,因此阳极不会产生氧气;
C.NO2与N2O4的最简式为NO2,根据最简式计算出34.5g二者的混合物中含有的氧原子数目;
D.氧化还原反应中,同一种元素的化合价向中间靠拢,氯酸钾中+5价的氯元素被还原成0价的氯气,生成3mol氯气转移了5mol电子.
B.电解硫酸钠溶液时,如果电极不是惰性电极,则阳极放电的不是氢氧根离子,因此阳极不会产生氧气;
C.NO2与N2O4的最简式为NO2,根据最简式计算出34.5g二者的混合物中含有的氧原子数目;
D.氧化还原反应中,同一种元素的化合价向中间靠拢,氯酸钾中+5价的氯元素被还原成0价的氯气,生成3mol氯气转移了5mol电子.
解答:
解:A.等物质的量的CH4和CO所含分子数相同,但是物质的量不一定为1mol,无法计算气体的分子数,故A错误;
B.电解饱和硫酸钠溶液时,若用惰性电极电解,生成2NA个H2,一定生成NA个O2,电解如果不是惰性电极,则阳极放电的不是氢氧根离子,电解过程中不会生成氧气,故B错误;
C.34.5g NO2与N2O4的混合物中含有最简式为NO2的物质的量为:
=0.75mol,含有氧原子的物质的量为1.5mol,含有1.5NA个氧原子,故C正确;
D.在KClO3+6HCl═KCl+3Cl2↑+3H2O中,根据同一种元素的化合价向中间靠拢原则,氯酸钾中+5价的氯元素被还原成0价的氯气,所以生成3mol氯气转移了5mol电子,转移电子数为5NA,故D错误;
故选C.
B.电解饱和硫酸钠溶液时,若用惰性电极电解,生成2NA个H2,一定生成NA个O2,电解如果不是惰性电极,则阳极放电的不是氢氧根离子,电解过程中不会生成氧气,故B错误;
C.34.5g NO2与N2O4的混合物中含有最简式为NO2的物质的量为:
| 34.5g |
| 46g/mol |
D.在KClO3+6HCl═KCl+3Cl2↑+3H2O中,根据同一种元素的化合价向中间靠拢原则,氯酸钾中+5价的氯元素被还原成0价的氯气,所以生成3mol氯气转移了5mol电子,转移电子数为5NA,故D错误;
故选C.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;选项B为易错点,注意明确电解硫酸钠溶液时是否采用惰性电极.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
下列说法不正确的是( )
| A、在一定条件下,催化分解80g SO3,混合气体中氧原子数为3×6.02×1023 |
| B、一定条件下,铁与水蒸气反应生成8.96L H2时(已折合成标况),转移的电子数为0.8×6.02×1023 |
| C、100mL 1mol/L AlCl3与3mol/L NaCl的混合溶液中,Cl-的个数为0.6×6.02×1023 |
| D、含有非极性键的数目为6.02×1023的Na2O2与水充分反应,标况下产生O2 22.4L |
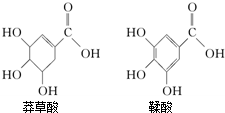 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物(如图)的说法正确的是( )
莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中.下列关于这两种有机化合物(如图)的说法正确的是( )| A、两种酸都能与溴水发生反应 |
| B、鞣酸分子与莽草酸分子相比多了两个碳碳双键 |
| C、1mol莽草酸完全燃烧消耗7mol O2 |
| D、等物质的量的两种酸与足量氢氧化钠反应,消耗氢氧化钠的量相同 |
某未知溶液中已检验出含大量的Fe2+、SO42-,且pH=1.欲检验此溶液中是否大量存在以下离子:①NH4+、②SiO32-、③Mg2+、④Cl-、⑤Ca2+、⑥ClO-,其中不需要检验就可以否定的离子是( )
| A、①③⑤ | B、②⑤⑥ |
| C、①②⑥ | D、③④⑥ |
验证汽油是混合物的方法是( )
| A、测量密度 | B、测沸点 |
| C、将汽油点燃 | D、闻气味 |
(CH3)2CHCH2OH是某有机物的加氢还原产物,该有机物可能是( )
| A、正丁醛的同分异构体 |
| B、正丁醛的同系物 |
| C、CH3CH2COCH3(2-丁酮) |
| D、CH2=C(CH3)CHO |
下列说法正确的是( )
| A、铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| B、氨水是弱碱,可用氨水与AlCl3溶液反应制Al(OH)3 |
| C、某些金属化合物具有特定的颜色,因此可制作烟花 |
| D、H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2 |
下列各组,可以用树状分类法进行分类的是( )
| A、烧杯、烧碱、燃烧、烧瓶 |
| B、酒精、酒精灯、水、盐酸 |
| C、干冰、一氧化碳、石墨、金刚石 |
| D、H2、HCl、NaOH、NaHCO3 |
下列除去杂质的方法错误的是( )
| A、除去SiO2中少量NH4Cl:在空气中充分灼烧 |
| B、除去铜器表面的铜绿[Cu2(OH)2CO3]:用盐酸浸泡,再用清水冲洗 |
| C、除去CO2中混有的少量的HCl:用NaOH溶液洗气,再干燥 |
| D、除去FeCl2溶液中混有的CuCl2:可在溶液中加入铁粉,充分反应后过滤 |